Massa volúmica
Referência : Ribeiro, D., (2014) Massa volúmica, Rev. Ciência Elem., V2(3):304
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.304]
A massa volúmica (vulgarmente designada por densidade absoluta ou, mais raramente, massa volumétrica) de uma substância é o quociente da massa da substância pelo seu volume

em que 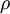 é a massa volúmica da substância,
é a massa volúmica da substância, 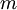 a massa do corpo e
a massa do corpo e 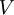 o seu volume. A massa volúmica exprime-se vulgarmente em g.cm-3 (ou kg/L) nos casos de estados condensados (sólidos e líquidos) e em g.L-1 (ou kg/m3) nos casos de gases.
o seu volume. A massa volúmica exprime-se vulgarmente em g.cm-3 (ou kg/L) nos casos de estados condensados (sólidos e líquidos) e em g.L-1 (ou kg/m3) nos casos de gases.
A mais antiga referência da utilização do conceito remonta a Arquimedes de Siracusa (287 a.C. – 212 a.C.). Vitrúvio conta[1] que Herão, o senhor de Siracusa, pediu a Arquimedes para que ele verificasse se a sua coroa era de ouro puro. Arquimedes fabricou dois blocos de igual massa, um de ouro e outro de cobre, e determinou os seus volumes a partir da impulsão sofrida pelos blocos quando imersos em água. Sem saber, Arquimedes utilizou o conceito de massa volúmica para verificar que a coroa de Herão não era de ouro puro.
Um pormenor histórico no que respeita a medições de densidades prende-se com a atividade de Henry Cavendish (1731 – 1810) que através de um método engenhoso[2] (no final do século XVIII), conseguiu determinar aproximadamente a densidade do planeta Terra – valor esse muito próximo do atualmente aceite.
A massa volúmica de uma substância é função da sua temperatura, visto que, quando se eleva a temperatura de uma substância, esta dilata-se (os corpúsculos que a constituem tendem a afastar-se mutuamente por aumento da agitação molecular). Este aumento de volume conduz a uma diminuição de massa volúmica.
Num gás, a medição da sua densidade, ou massa volúmica, depende da temperatura e também da pressão. Ao passo que os sólidos e os líquidos são praticamente incompressíveis, os gases são extremamente compressíveis e, por isso, dependendo da pressão a que um gás se encontra, a mesma massa de gás pode ocupar diferentes volumes e, consequentemente, apresentar diferentes massas volúmicas.
A densidade de um gás está, portanto, relacionada com a temperatura e com a pressão. Essa relação pode ser estabelecida a partir da equação dos gases ideais[3]
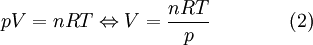
em que 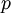 é a pressão a que o gás se encontra,
é a pressão a que o gás se encontra, 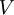 o seu volume,
o seu volume, 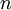 a quantidade de gás,
a quantidade de gás, 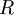 a constante universal dos gases perfeitos (8,31447 J.mol-1.K-1) e
a constante universal dos gases perfeitos (8,31447 J.mol-1.K-1) e 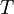 a sua temperatura absoluta.
a sua temperatura absoluta.
Pode-se exprimir 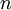 em função da massa
em função da massa 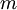 e da massa molar
e da massa molar 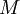 do gás
do gás
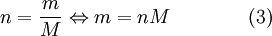
Substituindo (2) e (3) na equação (1), vem
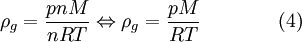
em que 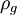 é a massa volúmica do gás e
é a massa volúmica do gás e 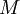 a sua massa molar.
a sua massa molar.
Assim, quando se pretende determinar a massa volúmica de uma substância, é necessário registar o valor das variáveis de que a densidade depende. No caso de sólidos e líquidos, o valor da densidade deve vir acompanhado da temperatura a que este foi determinado. Se a substância se encontrar no estado gasoso, o valor da massa volúmica deverá ser sempre acompanhado da temperatura e da pressão do gás.
A grandeza dimensional massa volúmicas não deve ser confundida com a grandeza física adimensional denominada densidade relativa que relaciona a densidade de uma substância com a de outra substância padronizada (a temperatura e pressão fixas).[4]
Referências
- P. La Cotardière, História das Ciências – da antiguidade aos nossos dias, Volume I, 1ª edição, Lisboa: Edições Texto & Grafia, Lda., 2010, ISBN: 978-989-8285-18-8.
- F. J. Moore, A History of Chemistry, 1st edition, New York: McGraw-Hill Book Company, Inc., 1918.
- P. Kulkarni, P. Baron, K. Willeke, eds., Aerosol measurement principles, techniques, and applications, Hoboken, N.J: Wiley, 2011, ISBN: 978-1-11-800166-0.
- C. Corrêa, F. P. Basto, N. Almeida, Química, 1ª edição, Porto: Porto Editora, 2008, ISBN: 978-972-0-42248-4.
Criada em 10 de Fevereiro de 2012
Revista em 16 de Março de 2012
Aceite pelo editor em 16 de Março de 2012
