Massa atómica relativa
Referência : Lima, L.S., (2013) Massa atómica relativa, Rev. Ciência Elem., V1(1):048
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2013.048]

A massa atómica relativa de um elemento X [símbolo Ar(X)] é a relação entre a média ponderada das massas atómicas dos isótopos naturais desse elemento relativamente e a massa de uma unidade tomada como padrão (indica o número de vezes que a massa atómica média de um elemento é maior que o valor padrão). É uma grandeza adimensional. O valor padrão é designado por unidade de massa atómica (“atomic mass unit”, símbolo amu ou, simplesmente, u) e representa um duodécimo (1/12) da massa de um átomo de carbono-12 no seu estado fundamental. O valor actualmente aceite para a unidade de massa atómica é u = 1,660 5402 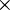 10-27 kg.
10-27 kg.
John Dalton, químico, físico e meteorologista inglês, foi o primeiro a determinar massas atómicas relativas e fê-lo no período entre 1803 e 1805, seguido pelo químico sueco Jöns Jacob Berzelius, que determinou valores de massas atómicas relativas entre 1808 e 1826. Os valores eram obtidos tendo como base o valor 1,00 atribuído ao hidrogénio, por ser o mais leve dos elementos. Durante a década de 60 do século XIX, o químico italiano Stanislao Cannizzaro utilizou a Lei de Avogadro para determinar com maior rigor valores de massas atómicas relativas e massas moleculares relativas. Entre o início do século XX e os anos 1959/1960, os químicos e os físicos utilizaram escalas de massas atómicas diferentes. Ambas se baseavam no elemento oxigénio, mas enquanto os químicos atribuíram o valor de massa atómica 16 à mistura natural dos isótopos de oxigénio, os físicos atribuíram o mesmo valor de massa atómica (16), mas apenas ao isótopo de oxigénio mais abundante (que é o que contém 8 protões e 8 neutrões no núcleo), o que levava a que as unidades de massa para químicos e físicos fossem diferentes, o que deu origem a duas tabelas diferentes para as massas atómicas relativas. A partir de 1959/1960, as organizações internacionais IUPAQ e IUPAP acordaram utilizar uma base comum para as massas atómicas: um dozeavos da massa do isótopo 12 do carbono. Actualmente, os valores das massas atómicas relativas dos elementos são revistos e actualizados bienalmente por uma comissão especializada da IUPAQ.[1]
A massa atómica relativa de um elemento é calculada a partir da média pesada das massas atómicas de cada um dos seus isótopos e da abundância relativa de cada um. Como exemplo de cálculo de uma massa atómica relativa de um elemento, considerem-se as massas atómicas e respectivas abundâncias relativas (expressas em fracção molar) dos isótopos do ferro, reunidas na tabela a seguir apresentada (a incerteza associada a cada valor é indicada entre parênteses).[[2]
| Isótopo | Massa atómica / u | Fracção molar |
|---|---|---|
| 54Fe | 53,939 6147(14) | 0,058 45(23) |
| 56Fe | 55,934 9418(15) | 0,917 54(24) |
| 57Fe | 56,935 3983(15) | 0,021 191(65) |
| 58Fe | 57,933 2801(15) | 0,002 819(27) |
O valor de Ar(Fe) é a média ponderada da massa dos isótopos atendendo à abundância relativa. Assim, Ar(Fe) = 53,939 6147 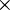 0,058 45 + 55,934 9418
0,058 45 + 55,934 9418 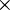 0,917 54 + 56,935 3983
0,917 54 + 56,935 3983 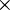 0,021 191 + 57,933 2801
0,021 191 + 57,933 2801 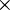 0,002 819 = 55,845(2).
0,002 819 = 55,845(2).
Referências
1. http://goldbook.iupac.org/S05907.html, consultado em 26/01/2010.
2. International Union of Pure and Applied Chemistry, Pure Appl. Chem. 74 (2002) 1987-2017.
Criada em 27 de Fevereiro de 2010
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010
