Ligando
Referência : Lima, L.S., (2014) Ligando, Rev. Ciência Elem., V2(4):310
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.310]

Um ligando é uma molécula ou ião que se liga a um catião metálico central para formar um complexo. Para tal são necessários, no mínimo, dois ligandos. Estes comportam-se, normalmente, como bases de Lewis, pois utilizam pelo menos um par dos seus electrões para formar uma ou mais ligações covalentes com o catião.
Os ligandos podem ser classificados de vários modos, atendendo a certas características, tais como o número de átomos coordenados ao catião central, a natureza dos átomos coordenantes, a sua carga, o número de electrões doados ao catião central, entre outras. Em seguida são apresentadas algumas das classificações mais comuns de ligandos:
- Quanto à carga
Os ligandos podem ser neutros (e.g. H2O, NH3, CO) ou aniónicos (e.g. Cl-, CN-, OH-, C2O42-).
- Quanto ao posicionamento face ao catião metálico central
Quando um ligando está coordenado directamente ao catião metálico, diz-se que faz parte da 1ª esfera de coordenação ou esfera de coordenação interna do complexo. Se o ligando não estiver directamente ligado ao catião central, mas sim a funcionar como contra-ião para balançar a possível carga positiva ou negativa do complexo metálico, então diz-se que faz parte da 2ª esfera de coordenação ou esfera de coordenação externa. Neste caso, estes ligandos estabelecem ligações fracas com os ligandos da 1ª esfera de coordenação. Se o complexo for neutro, não possui 2ª esfera de coordenação. A estrutura que engloba o catião metálico e a 1ª esfera de coordenação designa-se por complexo e a estrutura global (catião central + 1ª e 2ª esferas de coordenação) designa-se por composto de coordenação (electricamente neutro). Por exemplo, no composto de coordenação [Co(NH3)6]Cl3, a 1ª esfera de coordenação é composta pelo ião metálico cobalto (III) e os 6 ligandos amino (NH3), com os aniões Cl- a funcionarem como contra-iões. Se um dos aniões Cl- substituir um ligando NH3, passando a fazer parte da 1ª esfera de coordenação, o composto de coordenação resultante é [CoCl(NH3)5]Cl2 que, apesar das semelhanças com o anterior, tem propriedades bastante diferentes, a começar na própria cor de cada um: enquanto o primeiro é cor de laranja, o segundo é cor-de-rosa.
- Quanto à denticidade
A denticidade de um ligando refere-se ao número de átomos que estão coordenados ao ião central. Se está ligado por apenas um átomo, então o ligando designa-se monodentado (e.g. H2O, NH3, Br-). Se são dois ou mais os átomos não contíguos que estão ligados em simultâneo ao ião central, então o ligando é polidentado ou quelante (bidentado – e.g. etilenodiamina; tridentado – e.g. 1,4,7-triazaciclononano; tetradentado – e.g. trietilenotetramina; ...). Quando o ligando é quelante, normalmente o complexo designa-se por quelato. Quando um ligando possui dois átomos que se podem coordenar ao ião central sem ser em simultâneo, este denomina-se ambidentado, como é o caso do ião SCN-. Nos complexos onde se liga pelo átomo de enxofre o ligando designa-se por tiocianato, enquanto nos complexos onde se liga pelo átomo de azoto designa-se por isotiocianato.
- Quanto à hapticidade
Este termo é utilizado para descrever o número de átomos contíguos que estão coordenados ao ião metálico e é representado pela letra grega 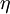 . O número de átomos contíguos é colocado no índice superior esquerdo. Por exemplo, o ferroceno é composto pelo ião central Fe2+ e por dois ligandos 5
. O número de átomos contíguos é colocado no índice superior esquerdo. Por exemplo, o ferroceno é composto pelo ião central Fe2+ e por dois ligandos 5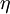 -ciclopentadienilo, o que significa que os 5 átomos de carbono de cada ligando participam na interacção com o ião central.
-ciclopentadienilo, o que significa que os 5 átomos de carbono de cada ligando participam na interacção com o ião central.
- Quanto à capacidade dadora e aceitadora de densidade electrónica
A natureza dos ligandos é determinante na definição de muitas das propriedades dos complexos, como a sua cor, as suas propriedades magnéticas e a sua reactividade. A degenerescência das 5 orbitais d do metal pode ser eliminada devido à sua interacção com as orbitais dos ligandos. Por exemplo, na geometria tetraédrica duas delas permanecem degeneradas mas diminuem a sua energia, enquanto as restantes também permanecem degeneradas entre si mas a um nível energético superior.
No caso da geometria octaédrica a situação é inversa. A diferença energética entre os dois conjuntos de orbitais nos complexos de ambas as geometrias depende essencialmente da natureza do ligando. Um ligando que tenha a capacidade de doar densidade electrónica 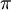 (e.g. Br-, Cl-, SCN-, NO3-) minimiza esta diferença energética, sendo designado ligando de campo fraco, enquanto um ligando aceitador de densidade electrónica
(e.g. Br-, Cl-, SCN-, NO3-) minimiza esta diferença energética, sendo designado ligando de campo fraco, enquanto um ligando aceitador de densidade electrónica 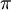 (e.g. CN-, CO, NO2-, trifenilfosfina) maximiza a diferença energética entre os dois conjuntos de orbitais degeneradas, sendo designado por ligando de campo forte.
(e.g. CN-, CO, NO2-, trifenilfosfina) maximiza a diferença energética entre os dois conjuntos de orbitais degeneradas, sendo designado por ligando de campo forte.
Aqueles que não são capazes nem de doar nem de receber densidade electrónica 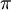 (e.g. H2O, NH3, etilenodiamina, piridina) causam um efeito intermédio e por isso são denominados ligandos de campo intermédio. Estes efeitos diferenciados dos ligandos conduziram à elaboração de uma classificação empírica comparativa, baseada na separação energética das orbitais d de valência dos catiões metálicos provocada por cada ligando, designada por série espectroquímica. Esta separação energética determina a forma de distribuição dos electrões pelas orbitais d de valência, que é a causa da cor dos complexos, da sua reactividade ou das suas propriedades magnéticas, entre outras.
(e.g. H2O, NH3, etilenodiamina, piridina) causam um efeito intermédio e por isso são denominados ligandos de campo intermédio. Estes efeitos diferenciados dos ligandos conduziram à elaboração de uma classificação empírica comparativa, baseada na separação energética das orbitais d de valência dos catiões metálicos provocada por cada ligando, designada por série espectroquímica. Esta separação energética determina a forma de distribuição dos electrões pelas orbitais d de valência, que é a causa da cor dos complexos, da sua reactividade ou das suas propriedades magnéticas, entre outras.
Refira-se que estas definições podem assumir um sentido mais lato na área da Bioquímica, onde, por exemplo, o catião cálcio pode ser considerado um ligando dado que se coordena à proteína calmodulina, considerada como o grupo central.[1]
Referências
1. http://goldbook.iupac.org/L03518.html, consultado em 01-02-2010
Criada em 6 de Março de 2010
Revista em 14 de Setembro de 2010
Aceite pelo editor em 14 de Setembro de 2010
