Indicador de ácido-base
Referência : Fernandes, R.F., (2014) Indicador de ácido-base, Rev. Ciência Elem., V2(1):132
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.132]

Um indicador de ácido-base é um composto (ácido ou base) que, em solução, apresenta uma cor que depende da acidez ou alcalinidade do meio (pH).[1]
Os indicadores apresentam uma determinada cor na forma ácida (HInd) e outra cor na forma de base conjugada (Ind-). A mudança de cor, resultante da conversão entre a forma ácida e a forma básica, ocorre devido à alteração da estrutura molecular do indicador, que é provocada pela entrada ou saída do protão (H+). Consequentemente, a modificação da estrutura do indicador leva a que seja absorvida luz com diferente comprimento de onda, o que origina cores distintas para cada uma das formas.
O equilíbrio entre a forma ácida (HInd) e a sua base conjugada (Ind-) é traduzido por:
HInd(aq) |
 |
H+(aq) |
+ |
Ind-(aq) |
A constante de protólise será:
![K_{Ind} = \frac{\left [ H^+ \right ] \left [ Ind^- \right ] }{\left [ HInd \right ]} = \left [ H^+ \right ] \frac{ \left [ Ind^- \right ] }{\left [ HInd \right ]} \qquad \qquad \qquad (1)](/wiki/images/math/9/5/a/95ab6215d11705714901f343a01bdd5f.png)
Aplicando o operador p (p= - log):
![\text{p}K_{Ind} = \text{pH} - \log\frac{ \left [ Ind^- \right ] } {\left [ HInd \right ]} \qquad \qquad \qquad \qquad \qquad (2)](/wiki/images/math/f/4/d/f4dc62d40fb6754e763b64a4261592b7.png)
![\log\frac{ \left [ Ind^- \right ] }{\left [ HInd \right ]} = \text{pH} - \text{p}K_{Ind} \qquad \qquad \qquad \qquad \qquad(3)](/wiki/images/math/f/0/1/f01434749cba255e3aa036222db30957.png)
Assim, para cada valor de pH, há um valor para a razão ![\frac{ \left [ Ind^- \right ] }{\left [ HInd \right ]}](/wiki/images/math/b/9/a/b9af1db6ef9a163d8a9c4abf9a4df215.png) que determina a cor da solução. Logo, a cor da solução dependerá da abundância relativa de Ind- e HInd. Geralmente, quando uma das espécies é cerca de 10 vezes mais abundante que a outra, a sua cor predominará o suficiente para se notar distintamente. Ou seja, se [Ind-]
que determina a cor da solução. Logo, a cor da solução dependerá da abundância relativa de Ind- e HInd. Geralmente, quando uma das espécies é cerca de 10 vezes mais abundante que a outra, a sua cor predominará o suficiente para se notar distintamente. Ou seja, se [Ind-]  10 × [HInd], a solução tem a cor de Ind- e um valor de pH
10 × [HInd], a solução tem a cor de Ind- e um valor de pH  pKInd + 1. Por outro lado se [HInd]
pKInd + 1. Por outro lado se [HInd] 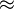 10 × [Ind-], a solução tem a cor de HInd e um valor de pH
10 × [Ind-], a solução tem a cor de HInd e um valor de pH 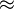 pKInd - 1.
pKInd - 1.
Deste modo, o intervalo [pKInd - 1 a pKInd + 1], no qual a solução apresenta uma mistura de cores, designa-se por zona de viragem do indicador. Na tabela seguinte apresentam-se algumas propriedades de alguns dos indicadores mais comuns:[2]
| Nome | Cor na forma ácida | Zona de viragem (pH) | pKIn | Cor na forma alcalina |
|---|---|---|---|---|
| Alaranjado de metilo | vermelha | 3,1 - 4,4 | 3,5 | amarela |
| Vermelho de metilo | vermelha | 4,4 - 6,2 | 5,0 | amarela |
| Azul de bromotimol | amarela | 6,0 - 7,6 | 7,3 | azul |
| Fenolftaleína | incolor | 8,0 - 9,8 | 9,5 | cor de rosa |
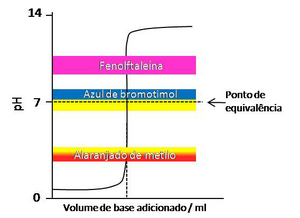
No planeamento de uma titulação, deve-se escolher um indicador cuja zona de viragem inclua, ou que seja o mais próximo possível, do pH no ponto de equivalência.
O diagrama da figura 1 representa a variação de pH com o volume adicionado de base numa titulação ácido forte-base forte (em solução aquosa, a 298,15 K (25,0 ºC)). Neste tipo de titulações, o valor de pH no ponto de equivalência é 7. Dos indicadores presentes no diagrama, verifica-se que o azul de bromotimol é o único cuja zona de viragem inclui o ponto de equivalência (pH=7). No entanto, como a variação de pH nas titulações ácido forte-base forte é muito brusca no ponto de equivalência, os indicadores alaranjado de metilo e fenolftaleína são também usados, uma vez que o valor de pH correspondente à mudança de cor está contido na zona de variação brusca do pH.
O pH de uma solução aquosa pode medir-se utilizando indicador universal, que é constituído por uma mistura de vários indicadores de pH (vermelho de metilo, azul de bromotimol, fenolftataleína, etc.). É comercializado sob a forma de solução ou imobilizado em tiras de papel absorvente, apresentando uma variação gradual de cor ao longo do intervalo de pH de 1 a 14. A figura 2 mostra as cores que o indicador universal apresenta de acordo com o pH.
Alguns pigmentos de plantas actuam como indicadores ácido-base, como por exemplo, as pétalas das flores da Hydrangea macrophylla que variam de cor em função do pH do solo, em que apresentam coloração azul em solos ácidos e coloração rosa em solos alcalinos (figura 3).
Referências
1. http://goldbook.iupac.org/A00075.html, consultado em 11/01/2010.
2. http://antoine.frostburg.edu/chem/senese/101/acidbase/indicators.shtml, consultado em 11/01/2010.
http://www.chemguide.co.uk/physical/acidbaseeqia/indicators.html, consultado em 11/01/2010.
http://www.avogadro.co.uk/chemist.htm, consultado em 11/01/2010.
Criada em 20 de Setembro de 2010
Revista em 28 de Setembro de 2010
Aceite pelo editor em 22 de Outubro de 2010