Fracção mássica e percentagem mássica
Referência : Lima, L.S., (2014) Fração mássica e percentagem mássica, Rev. Ciência Elem., V2(4):309
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.309]

A fracção mássica ou fracção em massa de um constituinte de uma mistura é o quociente entre a massa desse constituinte e a soma das massas de todos os constituintes da mistura,
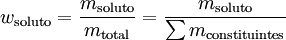
onde msoluto representa a massa de soluto, mtotal ou ∑mconstituintes representa a soma das massas de todas as substâncias presentes na solução ou na mistura.
Esta grandeza adimensional é uma forma conveniente de exprimir a composição quantitativa de misturas e, em particular, de soluções que, tal como a fracção molar e a molalidade, apresenta sobre as restantes formas de exprimir composições quantitativas a vantagem de não depender da temperatura. Além disso, pode preparar-se uma mistura com uma fracção mássica bem estabelecida e rigorosa apenas com base nas medições de massa das diferentes substâncias envolvidas.
A percentagem mássica ou percentagem em massa [%(m/m)] é o número de unidades de massa de um dado componente existente em 100 unidades de massa da mistura. Para uma solução, traduz-se matematicamente pela seguinte expressão:
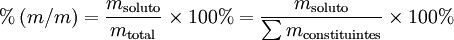
Por exemplo, o “ácido clorídrico comercial concentrado” é uma solução aquosa de cloreto de hidrogénio com uma percentagem em massa de 37%, o que significa que cada 100 g de solução contêm 37 g de cloreto de hidrogénio e também que a fracção mássica do soluto é 0,37. Para converter esta percentagem em concentração molar, é necessário o conhecimento da massa volúmica desta solução (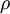 = 1,18 g
= 1,18 g  cm-3 a 20 oC) para calcular o volume de solução (100 g da solução concentrada correspondem a um volume de 84,7 cm3 a 20 oC). É, também, necessário conhecer a massa molar do soluto [M(HCl) = 36,46 g
cm-3 a 20 oC) para calcular o volume de solução (100 g da solução concentrada correspondem a um volume de 84,7 cm3 a 20 oC). É, também, necessário conhecer a massa molar do soluto [M(HCl) = 36,46 g  mol-1] para se poder calcular a quantidade de substância existente naquele volume de solução. Por fim, a partir da definição de concentração molar resulta que [HCl] ≈ 12 mol
mol-1] para se poder calcular a quantidade de substância existente naquele volume de solução. Por fim, a partir da definição de concentração molar resulta que [HCl] ≈ 12 mol  dm-3, isto é, uma solução concentrada de HCl com %(m/m) = 37% tem uma concentração de cloreto de hidrogénio 12 mol
dm-3, isto é, uma solução concentrada de HCl com %(m/m) = 37% tem uma concentração de cloreto de hidrogénio 12 mol  dm-3.
dm-3.
Criada em 2 de Novembro de 2009
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010
