Diferenças entre edições de "Fórmula empírica"
| (8 edições intermédias de 3 utilizadores não apresentadas) | |||
| Linha 1: | Linha 1: | ||
| − | <span style="font-size:8pt"><b>Referência : </b> | + | <span style="font-size:8pt"><b>Referência : </b> Fernandes, R.F., (2015) Fórmula empírica, ''[http://rce.casadasciencias.org Rev. Ciência Elem.]'', V3(4):244 |
| − | <span style="font-size:8pt"><b>Autor</b>: <i>Ricardo Ferreira Fernandes</i></span><br> | + | <br> |
| − | <span style="font-size:8pt"><b>Editor</b>: <i>[http://www.fc.up.pt/fcup/contactos/ficha_pessoal.php?login=jgoncalv Jorge Gonçalves]</i></span> | + | <span style="font-size:8pt"><b>Autor</b>: <i>[[Usuário:Rmfernandes|Ricardo Ferreira Fernandes]]</i></span><br> |
| − | + | <span style="font-size:8pt"><b>Editor</b>: <i>[http://www.fc.up.pt/fcup/contactos/ficha_pessoal.php?login=jgoncalv Jorge Gonçalves]</i></span><br> | |
| − | + | <span style="font-size:8pt"><b>DOI</b>: <i>[[http://doi.org/10.24927/rce2015.244 http://doi.org/10.24927/rce2015.244]]</i></span><br> | |
---- | ---- | ||
<p align='justify'>A '''fórmula empírica''' de um composto é a fórmula química mais simples possível e indica somente a relação entre o número de átomos de cada espécie. Por exemplo, a glucose apresenta a fórmula empírica CH<sub>2</sub>O, indicando que no composto, por cada átomo de carbono, existe um átomo de oxigénio e dois átomos de hidrogénio.</p> | <p align='justify'>A '''fórmula empírica''' de um composto é a fórmula química mais simples possível e indica somente a relação entre o número de átomos de cada espécie. Por exemplo, a glucose apresenta a fórmula empírica CH<sub>2</sub>O, indicando que no composto, por cada átomo de carbono, existe um átomo de oxigénio e dois átomos de hidrogénio.</p> | ||
| − | <p align='justify'>A fórmula empírica de um composto é | + | <p align='justify'>A fórmula empírica de um composto é determinada a partir da sua composição elementar. Assim, é necessário conhecer a percentagem mássica de cada elemento presente no composto, que é expressa, de acordo com a equação (1), pelo quociente entre a massa de cada elemento e a massa total da amostra:</p> |
| Linha 19: | Linha 19: | ||
<table width="150" border="0"> | <table width="150" border="0"> | ||
<tr> | <tr> | ||
| − | <td> | + | <td>40,92%</td> |
| − | <td><div align=" | + | <td><div align="left">Carbono (C)</div></td> |
</tr> | </tr> | ||
<tr> | <tr> | ||
| − | <td> | + | <td>4,58%</td> |
| − | <td><div align=" | + | <td><div align="left">Hidrogénio (H)</div></td> |
</tr> | </tr> | ||
<tr> | <tr> | ||
| − | <td> | + | <td>54,50%</td> |
| − | <td><div align=" | + | <td><div align="left">Oxigénio (O)</div></td> |
</tr> | </tr> | ||
</table> | </table> | ||
| − | <p align='justify'>Após se ter determinado a composição da amostra, o passo seguinte é | + | <p align='justify'>Após se ter determinado a composição da amostra, o passo seguinte é calcular para cada elemento a quantidade química relativa a partir da fracção mássica (ou da percentagem em massa) e da massa molar respectiva. A conversão pode ser facilmente feita considerando supondo que se tem uma massa total de 100 g de composto: </p> |
| − | <math>\text{Carbono}=\frac{40,92 \text{ g}}{12,01 \text{ g} \cdot \text{mol}^{-1}}=3,407 \text{ mol}</math> | + | <math>n_\text{Carbono}=\frac{40,92 \text{ g}}{12,01 \text{ g} \cdot \text{mol}^{-1}}=3,407 \text{ mol / 100g}</math> |
| − | <math>\text{Hidrog }\!\!\acute{\mathrm{e}}\!\!\text{ nio}=\frac{4, | + | <math>n_{\text{Hidrog }\!\!\acute{\mathrm{e}}\!\!\text{ nio}}=\frac{4,58 \text{ g}}{1,008 \text{ g} \cdot \text{mol}^{-1}}=4,54 \text{ mol / 100g}</math> |
| − | <math>\text{Oxig }\!\!\acute{\mathrm{e}}\!\!\text{ nio}=\frac{54,50 \text{ g}}{15,99 \text{ g} \cdot \text{mol}^{-1}}=3,406 \text{ mol}</math> | + | <math>n_{\text{Oxig }\!\!\acute{\mathrm{e}}\!\!\text{ nio}}=\frac{54,50 \text{ g}}{15,99 \text{ g} \cdot \text{mol}^{-1}}=3,406 \text{ mol / 100g}</math> |
| − | <p align='justify'>Verifica-se que os elementos C:H:O estão numa proporção 3,407: 4, | + | <p align='justify'>Verifica-se que os elementos C:H:O estão numa proporção 3,407: 4,54: 3,406. Assim, poderia representar-se o composto pela fórmula C<sub>3,407</sub>H<sub>4,54</sub>O<sub>3,406</sub>. No entanto, a fórmula empírica representa as proporções molares em que os elementos se encontram num composto utilizando os '''menores números inteiros'''. Um processo expedito de obter estes números (sem calcular o seu máximo divisor comum) consiste em dividir a quantidade relativa de cada elemento pelo menor número encontrado (neste caso, 3,406) obtendo-se uma proporção molar 1,00:1,33:1,00.</p> |
| − | <p align='justify'> | + | <p align='justify'>Como um dos números ainda não é inteiro, é necessário multiplicar os números obtidos por um factor até obter valores inteiros para todos os números da fórmula. Neste caso multiplicando por 3 obtém-se a proporção molar (e também atómica) 3:4:3 para os elementos C:H:O. Assim, o ácido ascórbico (vitamina C) apresenta a fórmula empírica C<sub>3</sub>H<sub>4</sub>O<sub>3</sub> , ou seja, por cada 3 átomos de carbono existem 4 átomos de hidrogénio e 3 átomos de oxigénio.</p> |
| Linha 54: | Linha 54: | ||
---- | ---- | ||
| − | <br>Criada em 10 de Abril de 2010<br> | + | <br>Criada em 10 de Abril de 2010<br> Revista em 02 de Fevereiro de 2011<br> Aceite pelo editor em 03 de Fevereiro de 2011<br> |
| − | Revista em | + | |
| − | Aceite pelo editor em | + | |
Edição actual desde as 16h53min de 12 de junho de 2018
Referência : Fernandes, R.F., (2015) Fórmula empírica, Rev. Ciência Elem., V3(4):244
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.244]
A fórmula empírica de um composto é a fórmula química mais simples possível e indica somente a relação entre o número de átomos de cada espécie. Por exemplo, a glucose apresenta a fórmula empírica CH2O, indicando que no composto, por cada átomo de carbono, existe um átomo de oxigénio e dois átomos de hidrogénio.
A fórmula empírica de um composto é determinada a partir da sua composição elementar. Assim, é necessário conhecer a percentagem mássica de cada elemento presente no composto, que é expressa, de acordo com a equação (1), pelo quociente entre a massa de cada elemento e a massa total da amostra:
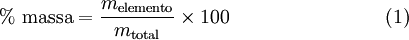
Recorrendo à análise elementar, é possível determinar a percentagem mássica de cada elemento existente num determinado composto. Veja-se o seguinte exemplo do estabelecimento da fórmula empírica do ácido ascórbico (vitamina C) a partir da sua composição elementar:
| 40,92% | Carbono (C) |
| 4,58% | Hidrogénio (H) |
| 54,50% | Oxigénio (O) |
Após se ter determinado a composição da amostra, o passo seguinte é calcular para cada elemento a quantidade química relativa a partir da fracção mássica (ou da percentagem em massa) e da massa molar respectiva. A conversão pode ser facilmente feita considerando supondo que se tem uma massa total de 100 g de composto:
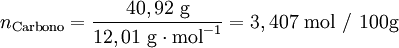
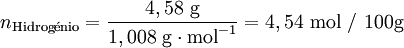
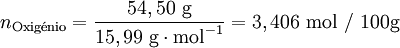
Verifica-se que os elementos C:H:O estão numa proporção 3,407: 4,54: 3,406. Assim, poderia representar-se o composto pela fórmula C3,407H4,54O3,406. No entanto, a fórmula empírica representa as proporções molares em que os elementos se encontram num composto utilizando os menores números inteiros. Um processo expedito de obter estes números (sem calcular o seu máximo divisor comum) consiste em dividir a quantidade relativa de cada elemento pelo menor número encontrado (neste caso, 3,406) obtendo-se uma proporção molar 1,00:1,33:1,00.
Como um dos números ainda não é inteiro, é necessário multiplicar os números obtidos por um factor até obter valores inteiros para todos os números da fórmula. Neste caso multiplicando por 3 obtém-se a proporção molar (e também atómica) 3:4:3 para os elementos C:H:O. Assim, o ácido ascórbico (vitamina C) apresenta a fórmula empírica C3H4O3 , ou seja, por cada 3 átomos de carbono existem 4 átomos de hidrogénio e 3 átomos de oxigénio.
Criada em 10 de Abril de 2010
Revista em 02 de Fevereiro de 2011
Aceite pelo editor em 03 de Fevereiro de 2011
