Estereoisómeros
Referência : Fernandes, R.F., (2014) Estereoisómeros, Rev. Ciência Elem., V2(4):311
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.311]

Os estereoisómeros (isómeros estereoquímicos) são compostos que apresentam a mesma fórmula de estrutura mas diferem na fórmula estereoquímica, ou seja, os átomos assumem diferentes posições relativas no espaço.
Os estereoisómeros foram descobertos pelo cientista francês Louis Pasteur, em 1849, quando analisava cristais de ácido tartárico tendo verificado que estes apresentavam duas formas distintas que eram a imagem uma da outra num espelho. Verificou-se, após a separação de cada uma das formas, que estas tinham a capacidade de rodar o plano de polarização da luz polarizada em sentidos opostos.
Os estereoisómeros que estão um para o outro como a imagem está para o objecto num espelho plano, designam-se por enantiómeros; quando esta relação não se verifica, denominam-se diasteroisómeros ou diastereómeros.
- Enantiómeros
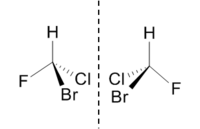
Os enantiómeros, como se exemplifica na figura 1, são isómeros que estão um para o outro como a imagem está para o objecto num espelho plano. Os enantiómeros apresentam propriedades químicas e físicas idênticas, excepto a capacidade de rodar o plano de luz polarizada (poder rotatório específico) que é igual mas de sinal contrário.
O limoneno é um composto de origem natural que se apresenta sob a forma de dois enantiómeros com fragrâncias distintas. O enantiómero S-limoneno ocorre no fruto dos pinheiros sendo responsável pelo forte odor do pinho, enquanto o enantiómero R-limoneno ocorre nas laranjas e é responsável pelo seu cheiro característico. A forma R-limoneno é muito utilizada como aditivo em produtos alimentares e medicamentos.
- Diasteroisómeros
Os diasteroisómeros são estereoisómeros que não estão um para o outro como a imagem está para o objecto num espelho plano. Os diasteroisómeros dividem-se em isómeros cis-trans e em confórmeros.
- Isómeros cis-trans
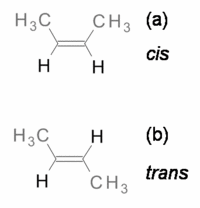
Os alcenos e os compostos cíclicos podem apresentar isómeros que diferem na posição dos átomos (ou grupos) relativamente a um plano de referência (do mesmo lado, na forma cis e em lados opostos, na forma trans). Por exemplo, o but-2-eno (figura 2) apresenta isomerismo cis-trans.
Os termos cis e trans derivam do latim, em que cis significa “do mesmo lado” e trans significa “do lado oposto”.
Os isómeros cis e trans geralmente apresentam propriedades físicas diferentes, por exemplo o seu momento dipolar, o que origina pontos de ebulição e de fusão diferentes.
O pent-2-eno apresenta uma temperatura de ebulição de 310 K (37 ºC) na forma cis e 309 K (36 ºC) na forma trans. Porém, quando estão presentes ligações polares as diferenças na temperatura de ebulição são maiores. Por exemplo, o cis-1,2-dicloroeteno, que tem ligações polares (C-Cl), apresenta uma temperatura de ebulição de 333 K (60 ºC) mas para o trans essa temperatura é de 321 K (48 ºC).
- Confórmeros
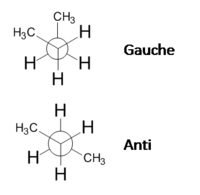
Os confórmeros são isómeros convertíveis uns nos outros por rotação em torno de uma ligação simples (ligação 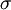 ). Os rotâmeros são os confórmeros que resultam da rotação em torno da mesma ligação simples. Por exemplo, a molécula do butano através da rotação em torno da ligação entre o segundo e o terceiro carbono origina dois rotâmeros de conformação alternada, o gauche em os grupos CH3 estão próximos, e o anti em que os grupos CH3 estão mais afastados (figura 3). Note-se que as rotações não ocorrem de modo inteiramente livre, existindo uma barreira energéticas que é necessário vencer, sendo a repulsão estereoquímica um dos efeitos que contribui para esta barreira.
). Os rotâmeros são os confórmeros que resultam da rotação em torno da mesma ligação simples. Por exemplo, a molécula do butano através da rotação em torno da ligação entre o segundo e o terceiro carbono origina dois rotâmeros de conformação alternada, o gauche em os grupos CH3 estão próximos, e o anti em que os grupos CH3 estão mais afastados (figura 3). Note-se que as rotações não ocorrem de modo inteiramente livre, existindo uma barreira energéticas que é necessário vencer, sendo a repulsão estereoquímica um dos efeitos que contribui para esta barreira.
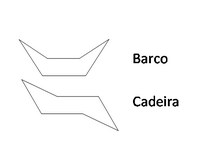
Os compostos cíclicos, devido às restrições de rotação das ligações entre os carbonos que se encontram ligados em forma de anel, não apresentam tantas conformações como os alcanos de cadeia aberta. No entanto, o anel apresenta alguma flexibilidade que depende do tamanho do anel. Por exemplo, o cicloexano, devido à possibilidade de rotação parcial em torno das ligações simples C-C, adopta diferentes conformações originando vários confórmeros, como as formas "barco" e "cadeira" (figura 4). À temperatura ambiente o cicloexano encontra-se 99.9 % na conformação em cadeira.
Referências
http://goldbook.iupac.org/C01093.html, consultado em 15/04/2010.
http://dwb4.unl.edu/chem_source_pdf/ORGN.pdf, consultado em 15/04/2010.
http://www.cem.msu.edu/~reusch/VirtualText/sterisom.htm, consultado em 15/04/2010.
Criada em 6 de Junho de 2010
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010