Limites de pH
Referência : Corrêa, C., (2014) Limites de pH, Rev. Ciência Elem., V2(2):180
Autor: Carlos Corrêa
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.180]

É vulgar considerar-se o pH variando entre 0 e 14, como se fosse impossível que pudesse apresentar valores fora deste intervalo, por exemplo –1 e 15. Na realidade, se a concentração de H+(aq) for igual a 10, o valor do pH é efectivamente –1. Analogamente, se [HO-] = 10 mol dm-3, o pH será 15.
dm-3, o pH será 15.
Foram já registados valores de pH de –1,7 a –3,6 em nascentes vulcânicas ricas em HCl e H2SO4 e em certas águas provenientes de minas[1]. A determinação destes valores de pH exigiu a utilização de soluções padrão de H2SO4 para as quais se calcularam as actividades por métodos adequados.
Uma solução aquosa com pH = 4 tem [H+(aq)] dez vezes maior que uma solução de pH = 5 e 10 vezes menor que uma solução aquosa de pH = 3. Será que uma solução aquosa de pH = –2 apresenta [H+(aq)] dez vezes maior que uma solução de pH = –1?
O pH foi definido para soluções aquosas diluídas de força iónica menor que 0,1 mol dm-3, a partir da actividade do ião H+(aq):
dm-3, a partir da actividade do ião H+(aq):
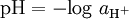 com
com 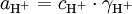
em que a = actividade, c = concentração, 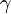 = factor de actividade e mede a capacidade de uma solução aquosa para doar protões.
= factor de actividade e mede a capacidade de uma solução aquosa para doar protões.
A actividade pode obter-se experimentalmente por meio de um eléctrodo de vidro combinado com um eléctrodo de referência (vulgarmente o eléctrodo de calomelanos ou o eléctrodo de cloreto de prata) a partir da equação
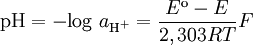
em que Eo é o potencial do eléctrodo de referência, E o potencial medido, R a constante dos gases, T a temperatura Kelvin e F a constante de Faraday.
Não se pode usar o eléctrodo de vidro em soluções muito concentradas, pois perde a linearidade, conduzindo a valores de pH incorrectos. Por esta razão, a escala de pH não deve ser usada para soluções muito concentradas porque não constitui uma verdadeira medida da acidez do meio.
Que sucede com soluções de ácidos e bases de maiores concentrações?
Á medida que as soluções se vão tornando mais concentradas aumentam as interacções entre as moléculas do soluto e o grau de ionização dos ácidos diminui. O ião oxónio, H3O+, em soluções aquosas diluídas encontra-se fortemente solvatado, com abundância de partículas H3O+(H2O)3, tendo uma capacidadade dadora de protões menor do que em soluções concentradas, em que há menor número de moléculas de água a solvatar os protões.
Assim, em soluções concentradas, apesar da menor ionização, a acidez do meio aumenta mais rapidamente que a concentração do H+(aq).
Para soluções concentradas de ácidos a acidez do meio é medida por outro tipo de funções, sendo a mais vulgar a Função de Acidez de Hammett, Ho[2], que se torna igual ao pH se as soluções aquosas forem diluídas.
A força de um ácido num dado solvente (capacidade do meio para doar protões) pode ser medida a partir da extensão da reacção do ácido com uma base fraca, B, denominada "indicador"*.
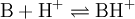
com ![K_{\text{BH}^+} = \frac{a_{\text{H}^+} \cdot a_\text{B}}{a_{\text{BH}^+}} = \frac{a_{\text{H}^+} [\text{B}] \gamma_\text{B}}{[\text{BH}^+] \cdot \gamma_{\text{BH}^+}} = h_o \frac{[\text{B}]}{[\text{BH}^+]}](/wiki/images/math/d/0/6/d06859e26cc66953d34e24cb41b0d067.png) onde
onde 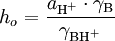 .
.
Para bases semelhantes, como anilinas substituídas utilizadas como indicadores, a razão dos coeficientes de actividade 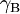 e
e 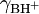 é praticamente constante e ho (e Ho = -log ho) é proporcional àa actividade do ião H+ na solução.
é praticamente constante e ho (e Ho = -log ho) é proporcional àa actividade do ião H+ na solução.
![H_o = -\text{log } h_o = \text{p}K_{\text{BH}^+} + \text{log } \frac{[\text{B}]}{[\text{BH}^+]}](/wiki/images/math/c/4/3/c43edab9d5bd645eb6de4df2ee818bd8.png)
Ho constitui uma medida da capacidade do meio (ácido + solvente) para doar protões, isto é, da actividade do ião hidrogénio, 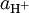 .
.
A base, B, escolhida deve ser tal que a razão ![\frac{[\text{B}]}{[\text{BH}^+]}](/wiki/images/math/3/4/d/34df56e0fe5c97be4c4fda542119ec55.png) possa ser determinada experimentalmente (por espectrofotometria, RMN e outras técnicas).
possa ser determinada experimentalmente (por espectrofotometria, RMN e outras técnicas).
Inicialmente utilizaram-se anilinas substituídas com grupos atraídores de electrões, em que a força da base pode ser regulada pela natureza e número dos substituintes.
A tabela 1 apresenta os valores de Ho para soluções aquosas concentradas dos ácidos mais vulgares[3].
| % (m/m) ácido | H2SO4 | HClO4 | HNO3 | HCl |
|---|---|---|---|---|
| 5 | 0,24 | 0,20 | 0,03 | -0,42 |
| 10 | 0,31 | -0,19 | -0,39 | -1,00 |
| 20 | -1,1 | -0,90 | -0,95 | -2,12 |
| 30 | -1,72 | -1,53 | -1,42 | -3,51 |
| 40 | -2,41 | -2,55 | -1,77 | - |
| 70 | -5,65 | -7,87 | - | - |
| 100 | -11,10 | - | - | - |
Estes valores não se podem relacionar com as concentrações de H+, como sucede com o pH. Por exemplo, para H2SO4, um valor de Ho = -11 não significa que a concentração de H+ seja igual a 1011 mol dm-3, pois tal solução teria uma densidade impossível (105 toneladas por dm3). Significa que a actividade dos protões naquele meio é 1011 vezes maior do que a actividade do H+(aq) numa solução aquosa de concentração igual a 1 mol
dm-3, pois tal solução teria uma densidade impossível (105 toneladas por dm3). Significa que a actividade dos protões naquele meio é 1011 vezes maior do que a actividade do H+(aq) numa solução aquosa de concentração igual a 1 mol dm-3.
dm-3.
Conhecido o valor da função Ho para um determinado meio, é possível obter os valores de 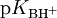 de ácidos conjugados de outras bases determinando experimentalmente o valor da razão [B]/[BH+] em soluções da base B no referido meio:
de ácidos conjugados de outras bases determinando experimentalmente o valor da razão [B]/[BH+] em soluções da base B no referido meio:
![\text{p}K_{\text{BH}^+} = H_\text{o} - \text{log } \frac{[\text{B}]}{[\text{BH}^+]}](/wiki/images/math/6/4/5/6456b2692c29a21b8611a8adf2a9f9ac.png)
Para soluções aquosas de bases muito concentradas foi introduzida uma função H –, definida de modo anólogo, que mede a capacidade do meio (S) para aceitar protões de um ácido fraco BH.[3]
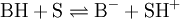
Os indicadores usados incluem anilinas e arilmetanos substituídos, que constituem ácidos muito fracos de onde o meio remove protões:
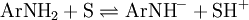
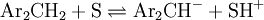
A tabela 2 apresenta os valores da função H – de vários sistemas [4].
| Solução | H - |
|---|---|
KOH 1 mol dm-3 dm-3 |
14,0 |
KOH 5 mol dm-3 dm-3 |
15,5 |
KOH 10 mol dm-3 dm-3 |
17,0 |
NaOCH3 1,0 mol dm-3 dm-3 |
17,0 |
NaOCH3 5,0 mol dm-3 dm-3 |
19,0 |
NaOCH3 0,01 mol dm-3 em DMSO-CH3OH 1:1 dm-3 em DMSO-CH3OH 1:1 |
15,0 |
NaOCH3 0,01 mol dm-3 em DMSO-CH3OH 10:1 dm-3 em DMSO-CH3OH 10:1 |
18,0 |
Em soluções aquosas diluídas, a função H – é igual ao pH, mas cresce mais rapidamente que o pH à medida que a basicidade do meio aumenta. Por exemplo, para uma solução aquosa de NaHO de concentração 10 mol dm-3,
H – = 16,4. À medida que a água vai sendo substituída por solventes polares apróticos, como sulfóxido de dimetilo (DMSO), a função H – cresce rapidamente
(para uma solução 0,01 mol
dm-3,
H – = 16,4. À medida que a água vai sendo substituída por solventes polares apróticos, como sulfóxido de dimetilo (DMSO), a função H – cresce rapidamente
(para uma solução 0,01 mol dm-3 de NaHO em H2O-DMSO(1:1) H – = 17,3).[5]
dm-3 de NaHO em H2O-DMSO(1:1) H – = 17,3).[5]
A partir dos valores da função H – é possível determinar a força de ácidos muito fracos, como os hidrocarbonetos, RH, bastando medir a razão [RH] / [R-] em meios em que a função H – é conhecida e calcular pKRH[6]:
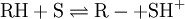
![\text{p}K_{\text{RH}} = H_\text{-} - \text{log } \frac{[\text{R}^-]}{[\text{RH}]}](/wiki/images/math/1/b/8/1b82fedb7a62fedee4c2e517e6c4397b.png)
* Extensão do termo "indicador" a pares conjugados ácido-base que apresentam "cores" diferentes, em que o termo "cor" se refere a qualquer comprimento de onda para além do visível.
Referências
1. K. F. Lim, Journal of Chem. Educ., 83, 1465 (2006).
2. L. P. Hammett, "Physical Organic Chemistry", 1970, 2nd edition, McGraw-Hill, p. 263.
3. R. S. Drago e N. A. Matwiyoff, "Acids and Bases", D. C. Heath & Company, 1968, p. 111.
4. F. A. Carey e R. J. Sundberg, "Advanced Organic Chemistry", Springer, 2007, p. 580.
5. E. Buncel, E. A. Symons, D. Dolman e R. Stewart, Can. J. Chem., 48, 3354 (1970).
6. R. Bowden e R. Stewart, Tetrahedron, 21, 261 (1965)
Criada em 10 de Julho de 2010
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010
