Fracção volúmica e percentagem em volume
Referência : Lima, L.S., (2014) Fração volúmica e percentagem em volume, Rev. Ciência Elem., V2(3):306
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.306]
A fracção volúmica ou fracção em volume de um constituinte de uma mistura é quociente entre o volume desse constituinte e a soma dos volumes de todos os constituintes antes de serem misturados.
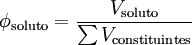
onde  representa a fracção mássica de soluto (ou de um constituinte da mistura), Vsoluto representa o volume de soluto (ou constituinte) e ∑ Vconstituintes representa a soma dos volumes de todos os constituintes (da solução ou mistura) antes de serem misturados.[1]
representa a fracção mássica de soluto (ou de um constituinte da mistura), Vsoluto representa o volume de soluto (ou constituinte) e ∑ Vconstituintes representa a soma dos volumes de todos os constituintes (da solução ou mistura) antes de serem misturados.[1]
Esta grandeza adimensional é uma forma conveniente de exprimir a composição quantitativa quando se misturam dois ou mais líquidos ou quando se misturam diferentes gases para formar uma solução. Como todos os componentes se encontram na mesma fase, o solvente será o que existe em maior quantidade.
A percentagem em volume ou percentagem volúmica [%(V/V)] é igual à fracção volúmica multiplicada por 100% e representa o volume de um dado componente existente em 100 volumes da mistura, considerando aditivos os volumes medidos antes de se misturarem, e traduz-se matematicamente pela seguinte equação:
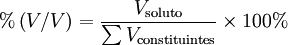
Por exemplo, uma bebida alcoólica que tenha um teor de etanol de 12 %(V/V) significa que se pode obter uma solução idêntica a essa por mistura de 12 mL de etanol e 88 mL de água. Não significa que se obtenham 100 mL de solução porque, devido à contracção do volume aquando da mistura destas duas substâncias, o volume da solução será inferior à soma dos volumes dos constituintes antes da mistura. No entanto, tal como para a percentagem em massa, a soma das percentagens em volume é sempre igual a 100%, isto é a 1, pois o divisor não é Vsolução.[1] Do mesmo modo, no caso de gases, os valores de %(V/V) são aditivos.
Referências
1. http://goldbook.iupac.org/V06643.html, consultado em 01/05/2010.
Criada em 2 de Novembro de 2009
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010
