Fórmula estereoquímica
Referência : Fernandes, R.F., (2015) Fórmula estereoquímica, Rev. Ciência Elem., V3(4):245
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.245]
A fórmula estereoquímica é uma representação que indica a disposição espacial relativa dos átomos numa molécula (figura 1).
Estas fórmulas foram introduzidas, por volta de 1859, no âmbito da estereoquímica (área que estuda as propriedades químicas dos compostos em função da disposição espacial dos átomos que compõem as moléculas) quando o químico francês Louis Pasteur observava cristais de sais do ácido tartárico. Pasteur verificou que os cristais apresentavam duas formas distintas que eram a imagem uma da outra num espelho. Quando separadas, estas duas formas de cristais apresentavam actividade optica, isto é, tinham a capacidade de rodar o plano de polarização da luz polarizada. Posteriormente, em 1872, o químico holandês Jacobus Henricus van’t Hoff, baseado na tetravalência do carbono enunciada pelo químico alemão August Kekulé, propôs que a actividade óptica poderia ser explicada a partir dos arranjos espaciais dos substituintes em torno do carbono.
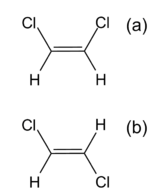
As fórmulas estereoquímicas permitem compreender a relação entre a disposição espacial dos átomos e as propriedades das moléculas. Veja-se o exemplo dos isómeros cis-trans do 1,2-dicloroeteno (figura 2), em que os átomos de cloro se podem encontrar do mesmo lado ou em lados opostos da ligação dupla. Como consequência, as duas moléculas apresentam diferentes momentos dipolares, o que afecta várias propriedades físicas. A forma cis, de maior polaridade, será menos volátil. Assim, a temperatura de ebulição é 333 K (60 ºC) para a forma cis e 321 K (48 ºC) para a forma trans.
O arranjo espacial relativo dos átomos nas moléculas pode também ser representado de um modo simplificado através da projecção da molécula no plano da folha de leitura (plano do papel). As projecções de Fisher, Haworth e Newman são as mais conhecidas.
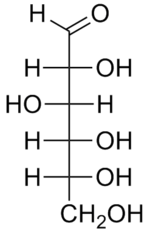
As projecções de Fisher, assim designadas em homenagem ao químico alemão Hermann Emil Fisher, são particularmente utilizadas em Química Orgânica na representação de monossacarídeos (glucose, frutose). Nestas projecções, cada carbono e as quatro ligações que dele partem representam-se por uma cruz, na qual o átomo central (carbono) se encontra no ponto de intersecção. As linhas horizontais representam as ligações que estão na direcção do observador (para a frente do plano do papel) e as linhas verticais as ligações que se afastam do utilizador (para trás do plano do papel). A figura 3 representa a projecção de Fisher para a D-glucose.
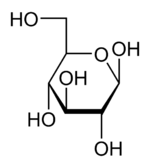
As projecções de Haworth, assim denominadas em homenagem ao químico inglês Sir Walter Norman Haworth que as introduziu, utilizam-se para representar a estrutura tridimensional das formas cíclicas dos monossacarídeos. Nestas projecções, o anel é representado por um hexágono tendo como vérices um átomo de oxigénio e cinco átomos de carbono; os substituintes colocam-se nos extremos de segmentos de recta verticais, que partem dos vértices, para cima ou para baixo, conforme se trate de substituintes acima ou abaixo do plano do hexágono (figura 4).
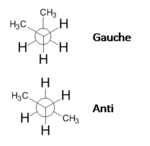
As projecções de Newman, assim denominadas em homenagem ao químico norte-americano Melvin Spencer Newman, utilizam-se para representar a disposição espacial de 6 substituintes em torno de dois carbonos adjacentes. Consistem na projecção das 6 ligações e substituintes num plano perpendicular à ligação C-C (plano do papel). Utilizam-se para representar confórmeros. Os substituintes ligados ao átomo de carbono mais próximo do observador são ligados ao centro de um pequeno círculo, enquanto os substituintes ligados ao carbono mais afastado ligam-se à parte exterior do círculo (figura 5). Representam aquilo que um observador veria se olhasse a molécula na direcção da ligação C-C.
Referências
IUPAC Gold Book: stereochemical formula, consultado em 30/06/2010.
IUPAC Gold Book: projection formula, consultado em 30/06/2010.
IUPAC Gold Book: Fischer projection, consultado em 30/06/2010.
IUPAC Gold Book: Newman projection, consultado em 30/06/2010.
Chemical Heritage Foundation: Jacobus Henricus van’t Hoff, consultado em 30/06/2010.
Criada em 14 de Dezembro de 2010
Revista em 15 de Dezembro de 2010
Aceite pelo editor em 16 de Dezembro de 2010