Energia
Referência : Ribeiro, D., (2014) Energia, Rev. Ciência Elem., V2(2):176
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.176]

A energia é a característica de um sistema que lhe permite realizar trabalho.[1] O conceito de energia é dos mais importantes em Física e Química e, porém, dos mais abstratos. Muitos são aqueles que trabalham as leis referentes à energia, mas poucos são os que a definem. A energia não pode ser observada, porém, as suas manifestações são claramente visíveis em todo o Universo.
Apesar do termo energia derivar do grego antigo, a sua utilização teve várias conotações ao longo dos tempos. Em 1802, o inglês Thomas Young (1773 – 1829) foi o primeiro a utilizar o equivalente moderno de energia. Antes, o termo utilizado para descrever o conceito era o termo vis viva, ou força da vida, introduzido pela primeira vez por Gottfried Leibniz (1646 – 1716). Este último termo nasceu profundamente arraigado ao conceito religioso da ciência dos séculos anteriores ao século XIX. No entanto, formalmente, a vis viva de Leibniz correspondia ao dobro da energia cinética de uma partícula 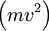 .
.
A utilização do termo energia, ainda hoje, tem múltiplos significados[2] (dependendo do tipo de energia que esteja em consideração). Em mecânica, por exemplo, a energia corresponde à soma da energia cinética com a energia potencial,
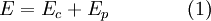
Por outro lado, em termodinâmica, a energia total de um sistema é designada energia interna, 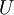 .[3] Esta última pode ser definida como uma soma de todas as formas microscópicas de energia de um sistema. É a energia associada quer à dinâmica dos átomos e/ou moléculas do sistema (energia cinética), quer à estrutura atómica e/ou molecular do sistema (energia potencial).[4] A energia interna pode, assim, ser definida como a energia necessária para criar um sistema termodinâmico. Neste sentido, e à semelhança da equação (1), a energia interna também pode ser definida como a soma da energia cinética e potencial do sistema termodinâmico,
.[3] Esta última pode ser definida como uma soma de todas as formas microscópicas de energia de um sistema. É a energia associada quer à dinâmica dos átomos e/ou moléculas do sistema (energia cinética), quer à estrutura atómica e/ou molecular do sistema (energia potencial).[4] A energia interna pode, assim, ser definida como a energia necessária para criar um sistema termodinâmico. Neste sentido, e à semelhança da equação (1), a energia interna também pode ser definida como a soma da energia cinética e potencial do sistema termodinâmico,
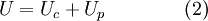
No caso específico de um sistema apenas poder efetuar trocas de energia com a vizinhança, as variações de energia interna podem ser definidas matematicamente de uma forma muito simples, visto que resultam da soma entre as variações de calor e as variações de trabalho do sistema termodinâmico em questão,
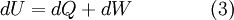
A energia que um fotão possui pode ser dada matematicamente por

em que 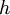 é a constante de Planck (6,626 x 10-34 J.s) e
é a constante de Planck (6,626 x 10-34 J.s) e 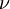 a frequência da radiação.
a frequência da radiação.
Um outro exemplo de energia corresponde à sua utilização no contexto da física relativista; neste caso, a denominada energia de repouso é dada por

em que 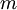 é a massa da partícula e
é a massa da partícula e 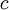 a velocidade da luz no vazio (3 x 108 m.s-1).
a velocidade da luz no vazio (3 x 108 m.s-1).
O conceito de energia está intimamente ligado com outro conceito muito importante em Química: o de conservação de energia. A conservação da energia estabelece que a quantidade total de energia num sistema isolado é invariável. Isto significa que a energia nem pode ser criada, nem poder ser destruída – apenas pode ser convertida nas suas diferentes manifestações. Universalmente, e em última análise, isto denota que todas as diferentes relações para definir as diferentes manifestações de energia são formas de definir o mesmo, e único, conceito invariável em todo o Universo.
Referências
- D. R. Lide, ed., CRC Handbook of Cemistry and Physics, 89th edition, Boca Raton, Fla. London: CRC, 2008, ISBN: 978-1-420-06679-1.
- IUPAC Gold Book: Energy, consultado em 08/12/2011.
- P. Atkins, Atkins' Physical Chemistry, 8th edition, Oxford New York: Oxford University Press, 2006, ISBN: 978-0-198-70072-2.
- E. Rathakrishnan, Fundamentals of Engineering Thermodynamics, 2nd edition, New Delhi: Prentice-Hall of India Private Limited, 2006, ISBN: 812032790X.
Criada em 06 de Janeiro de 2012
Revista em 13 de Janeiro de 2012
Aceite pelo editor em 16 de Janeiro de 2012
