Calor
Referência : Ribeiro, D., (2014) Calor, Rev. Ciência Elem., V2(1):121
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.121]

O calor consiste na energia transferida de uma fonte quente para uma fonte fria devido a um gradiente térmico.[1] Quando a energia de um sistema termodinâmico varia como resultado de uma diferença de temperaturas entre o sistema e a vizinhança, diz-se que ocorreu uma transferência de energia como calor.
As noções de calor e de temperatura são muitas vezes confundidas na linguagem comum. Apesar de estritamente diferentes sob o ponto de vista científico, as duas noções estão interligadas e a própria história da termodinâmica induziu por vezes a tal confusão‡.
No século XVII, cientistas como Galileu Galilei (1564 – 1642) e Sir Isaac Newton (1643 – 1727) concordavam, na generalidade, com a teoria dos atomistas da Grécia Antiga que consideravam o calor como uma manifestação do movimento molecular. Posteriormente, no século XVIII, foram desenvolvidos alguns métodos para efectuar medições da quantidade de calor que saía ou entrava num objeto.[2] Estas medições permitiram verificar que, quando dois objetos se encontravam em contato, a quantidade de calor que saía de um objeto era a mesma que entrava no outro. Esta verificação conduziu à elaboração da teoria do calórico que assemelhava o calor a um fluido: um motor térmico só poderia funcionar se o calor passasse de um corpo a temperatura mais elevada para um corpo a temperatura mais baixa em analogia a uma máquina hidráulica que obtinha energia da passagem da água de um reservatório de altitude elevada para um reservatório de altitude inferior.
Benjamin Thompson, conde Rumford (1753 – 1814), efetuou uma observação determinante para o abandono do conceito de calórico: verificou que, quando se enchia com pólvora a alma de um canhão, se libertava muito calor. Além disso, quando se utilizava um utensílio rombo para comprimir a pólvora, este procedimento produzia ainda mais calor.[3] Assim, Thompson concluiu que o próprio trabalho produzia o calor e este último não provinha de nenhum armazenamento de calórico escondido no metal. O cientista britânico Humphrey Davy (1778 – 1829) mostrou que até mesmo dois blocos de gelo fundem quando são friccionados um contra o outro.
Em 1824, Sadi Carnot (1796 – 1832), embora acreditasse que o calor fosse um fluido material, publicou um artigo onde mostrava que o calor podia ser convertido em trabalho graças à diferença de temperaturas entre uma fonte fria e uma fonte quente. Ele introduziu o conceito de processo reversível e mostrou que o funcionamento de uma máquina térmica ideal é uma sequência de ciclos, cada um com quatro fases reversíveis (o ciclo de Carnot). Além disto, Carnot mostrou que a potência máxima possível no processo de conversão de calor em trabalho era independente do fluido que se utilizasse nas fontes e unicamente dependente da diferença de temperatura das fontes. O próprio Carnot designou esta descoberta como “a queda do calórico”[3].
A teoria moderna do calor emergiu apenas na década de 1840, quando James Joule (1818 – 1889) mostrou que os ganhos ou percas de calor eram compensados pelo aparecimento ou desaparecimento de uma quantidade equivalente de energia mecânica. Em 1850, o alemão Rudolf Clausius (1822 – 1888) propôs que a equivalência calor-trabalho era totalmente compatível com a ‘queda’ (variação de temperatura) descrita por Carnot. A partir do princípio da conservação da energia, Clausius deduziu que, numa máquina térmica, o calor contido no fluido se reparte entre o trabalho extraído da máquina e a energia calorífica restituída à fonte fria, visto que, segundo Clausius, o calor não podia passar espontaneamente de uma fonte para outra mais quente.
Desta e de outras verificações surgiu a ideia de que, sabendo a variação da energia interna de um sistema e o trabalho realizado, é possível determinar as trocas de calor inerentes a um determinado processo termodinâmico,
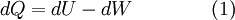
em que 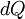 traduz a variação infinitesimal de calor,
traduz a variação infinitesimal de calor, 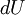 a variação de energia interna e
a variação de energia interna e 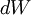 o trabalho efectuado. Isto decorre da equivalência entre trabalho e calor e do facto de que, num sistema fechado, a energia total transferida para um sistema é igual à variação da sua energia interna.
o trabalho efectuado. Isto decorre da equivalência entre trabalho e calor e do facto de que, num sistema fechado, a energia total transferida para um sistema é igual à variação da sua energia interna.
Só com o advento da termodinâmica estatística, se definiu o calor como transferência da agitação térmica das partículas ao nível microscópico. Um sistema cujas partículas estejam estatisticamente mais agitadas (com maior energia cinética) apresentará uma mais elevada temperatura do equilíbrio definido à escala macroscópica. A temperatura é, assim, uma grandeza macroscópica que é o reflexo estatístico das energias cinéticas das partículas à escala microscópica. Ao chocarem aleatoriamente, as partículas com maior agitação transmitem energia cinética às partículas menos agitadas. O saldo das transferências de energias cinéticas microscópicas corresponde ao calor permutado entre sistemas cuja agitação térmica média é diferente. A temperatura é, assim, uma função de estado intensiva descritora do estado de equilíbrio de um sistema enquanto o calor é a transferência de agitação térmica assimilável a uma quantidade de energia associada à evolução de um sistema entre dois estados distintos (ou idênticos se a transformação for cíclica).
Em alguns termos termodinâmicos compostos surgia a palavra calor; atualmente utilizam-se terminologias sem ambiguidade: variação de entalpia, 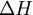 , em vez de calor a pressão constante,
, em vez de calor a pressão constante, 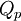 , e variação de energia interna,
, e variação de energia interna, 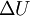 , em vez de calor a volume constante,
, em vez de calor a volume constante, 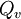 .[4] Para uma mudança de estado
.[4] Para uma mudança de estado 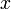 a pressão e temperatura constantes (
a pressão e temperatura constantes (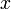 = fusão, vaporização, sublimação, etc.) deve utilizar-se a designação variação de entalpia de
= fusão, vaporização, sublimação, etc.) deve utilizar-se a designação variação de entalpia de 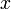 ,
, 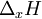 em vez de calor latente de
em vez de calor latente de 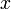 ,
, 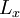 .
.
‡ O uso corrente de expressões como “a água está quente” confere à palavra «calor» uma notável ambiguidade: subentende-se que o calor é uma forma de energia armazenada pela água embora o calor seja apenas uma forma de transferir energia.
Referências
- IUPAC Gold Book: Heat, consultado em 07/11/2011.
- P. A. Tipler, G. Mosca, Physics for Scientists and Engineers, 5th edition, New York: W. H. Freeman, 2004, ISBN: 978-0716743897.
- P. La Cotardière, História das Ciências – da antiguidade aos nossos dias, Volume I, 1ª edição, Lisboa: Edições Texto & Grafia, Lda., 2010, ISBN: 978-989-8285-18-8.
- C. Corrêa, F. P. Basto, Química – 12º ano – 2ª Parte, Porto: Porto Editora, 2002, ISBN: 972-0-42233-5.
Criada em 16 de Janeiro de 2012
Revista em 17 de Janeiro de 2012
Aceite pelo editor em 23 de Janeiro de 2012
