Eletrólise da água na obtenção de hidrogénio
Referência : Gomes, J., (2022) Eletrólise da água na obtenção de hidrogénio, Rev. Ciência Elem., V10(2):025
Autor: João Gomes
Editor: João Nuno Tavares
DOI: [https://doi.org/10.24927/rce2022.025]

Resumo
Nesta comunicação ressaltam-se os aspetos relativos ao conhecimento já existente em Portugal sobre a tecnologia da eletrólise da água que podem, em grande medida, ser incorporados nos desenvolvimentos tecnológicos que serão necessários fazer no âmbito do processo de descarbonização e produção de hidrogénio verde.
Em 1944 foi publicada a célebre Lei 2002 da Eletrificação do País, por ação do Prof. Eng. Ferreira Dias, que havia definido a etapa da eletrificação como primordial para se proceder à industrialização do país[1]. Na sequência desta lei e da implementação das ações de eletrificação assistiu-se, desde então, à instalação de diversas unidades industriais com especial recurso à eletricidade como fonte de energia. Encontram-se, neste caso, as unidades nacionais de produção de hidrogénio eletrolítico destinadas ao fabrico de amoníaco e, posteriormente, adubos azotados, assim como as unidades de fabrico de cloro e soda, igualmente por técnicas eletrolíticas. Em 1946, verificou- -se o arranque da unidade do Amoníaco Português, em Estarreja, produzindo 800 m3/h de hidrogénio, beneficiando dos empreendimentos hidroelétricos do Cávado e Douro, produzindo-se no mesmo local sulfato de amónio, a partir de ácido sulfúrico e amoníaco.
Em 1952 verificou-se o arranque da unidade da União Fabril do Azoto, em Alferrarede (Abrantes), beneficiando do arranque da barragem de Castelo de Bode (Zêzere) que produzia 34 t/dia de amoníaco, aumentando a sua capacidade para 48 t/dia em 1955 e, depois, para 55 ton/dia a partir de 1957. Esta unidade produzia apenas o amoníaco que era posteriormente enviado, por vagão cisterna, para o Lavradio (Barreiro), onde se fabricava sulfato de amónio e uma gama mais vasta de adubos azotados. Foram, precisamente, os custos de transporte do amoníaco, assim como a subida dos custos de energia elétrica, que vieram determinar o encerramento desta instalação durante a década de 60 do século passado, passando o amoníaco a ser fabricado no Lavradio, pelo processo Haber-Bosch, mas com o hidrogénio obtido pelo processo petroquímico de cracking de nafta a partir de 1963, com uma capacidade inicial de 170 t/dia. Esta unidade encerrou em 1984, tendo sido substituída por outra, funcionando pelo mesmo processo, mas já com uma capacidade de 900 t/dia que esteve em produção durante muitos anos, até que a baixa de preço do amoníaco no mercado internacional ditou o seu encerramento e desmantelamento, já no início deste século.
A indústria química de síntese, quer inorgânica, quer orgânica, é um consumidor intensivo de energia, sendo que esta última, a ser cara, inviabiliza o seu desenvolvimento. Os casos das unidades anteriormente referidas de produção de hidrogénio eletrolítico são paradigmáticos de uma situação de consumo intensivo de energia elétrica que hoje poderia ser classificado como produção de hidrogénio “verde” e que foi abandonado, durante décadas, em Portugal e em outros países europeus, a favor de processos de produção de hidrogénio muitíssimo mais intensivos em carbono, já que recorre ao uso de energia fóssil (nafta), com uma pegada carbónica dificilmente sustentável nos dias de hoje.
Se bem que a subida dos preços de eletricidade para a indústria ditou, assim, o abandono de diversas unidades industriais, verificou-se o acumular de know-how específico sobre o funcionamento das mesmas, assim como ao conhecimento de inúmeros pormenores operacionais que permitiram, por exemplo, que a unidade de Alferrarede aumentasse a sua capacidade de produção em cerca de 30%, sem revamping significativo, após poucos anos de operação. Além disso, os técnicos que operavam estas unidades dedicaram-se, durante muito tempo, a tarefas de investigação industrial[2], [3], que resultaram em importantes ganhos em otimização processual e integração energética que, anos mais tarde, originaram um modo de estar e de agir que se veio a traduzir, por exemplo, no revamping e na reconfiguração do complexo industrial de Estarreja, subtraindo-o (literalmente) a uma morte anunciada muitos anos antes.
Na verdade, a atual política europeia de descarbonização e o enveredar por uma economia baseada, em grande medida, no hidrogénio verde[4], leva ao revitalizar de técnicas e processos quase antigos, como é o caso da eletrólise, em que grande parte do conhecimento acumulado durante os anos em que as unidades industriais estiveram em operação em Portugal, podem fazer muito para ultrapassar problemas tecnológicos ainda existentes, mercê de investimentos que se consideram necessários em investigação e desenvolvimento nesta área.
A química do processo de eletrólise de água
A eletrólise de água é a reação química de oxirredução provocada pela passagem de corrente elétrica contínua, correspondente à dissociação da molécula de água nos seus constituintes, a saber, o hidrogénio e o oxigénio, na presença de um eletrólito, como se representa esquematicamente na FIGURA 1. A eletrólise de água foi descrita cerca de 1800 na sequência dos estudos de Alessandro Volta e Humphry Davy e, em 1869, o belga Zenobe Gramme desenvolveu a máquina de Gramme e o que foi considerado um processo de baixo custo de obtenção de hidrogénio.
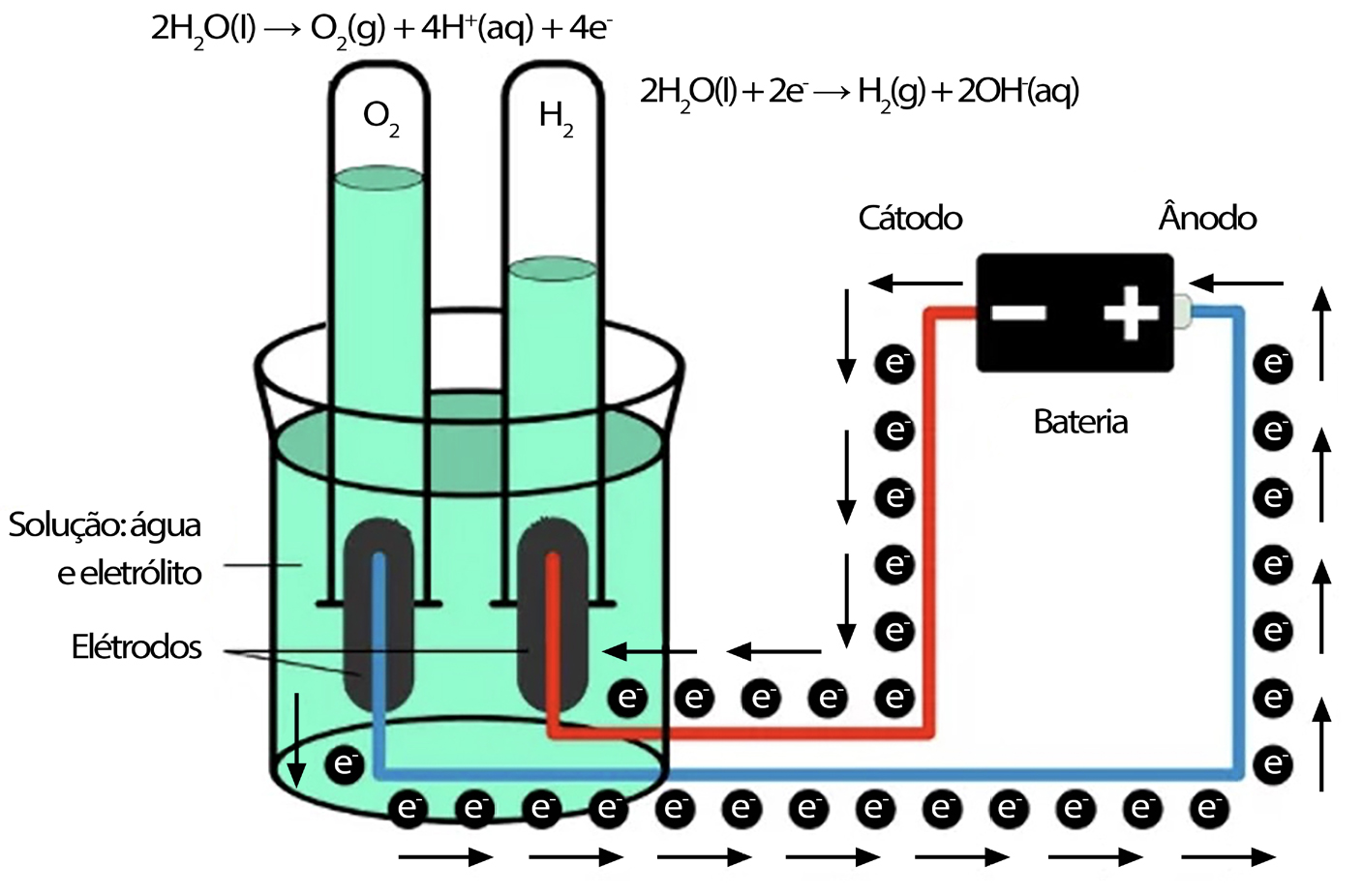
Considerando água pura, no cátodo, carregado negativamente, dá-se uma reação de redução com o fornecimento de eletrões para catiões de hidrogénio para formar o hidrogénio gasoso:
2H+(aq) + 2e- \(\rightarrow\) H2(g)
No ânodo, carregado positivamente, dá-se uma reação de oxidação, gerando oxigénio gasoso e fornecendo eletrões ao ânodo para fechar o circuito:
2H2O(l) \(\rightarrow\) O2(g) + 4H+(aq) + 4e-
ou seja:
- Redução no cátodo: 2H2O(l) + 2e- \(\rightarrow\) H2(g) + 2OH-(aq)
- oxidação no ânodo: 2OH-(aq) \(\rightarrow\) ½ O2(g) + H2O(l) + 2e-
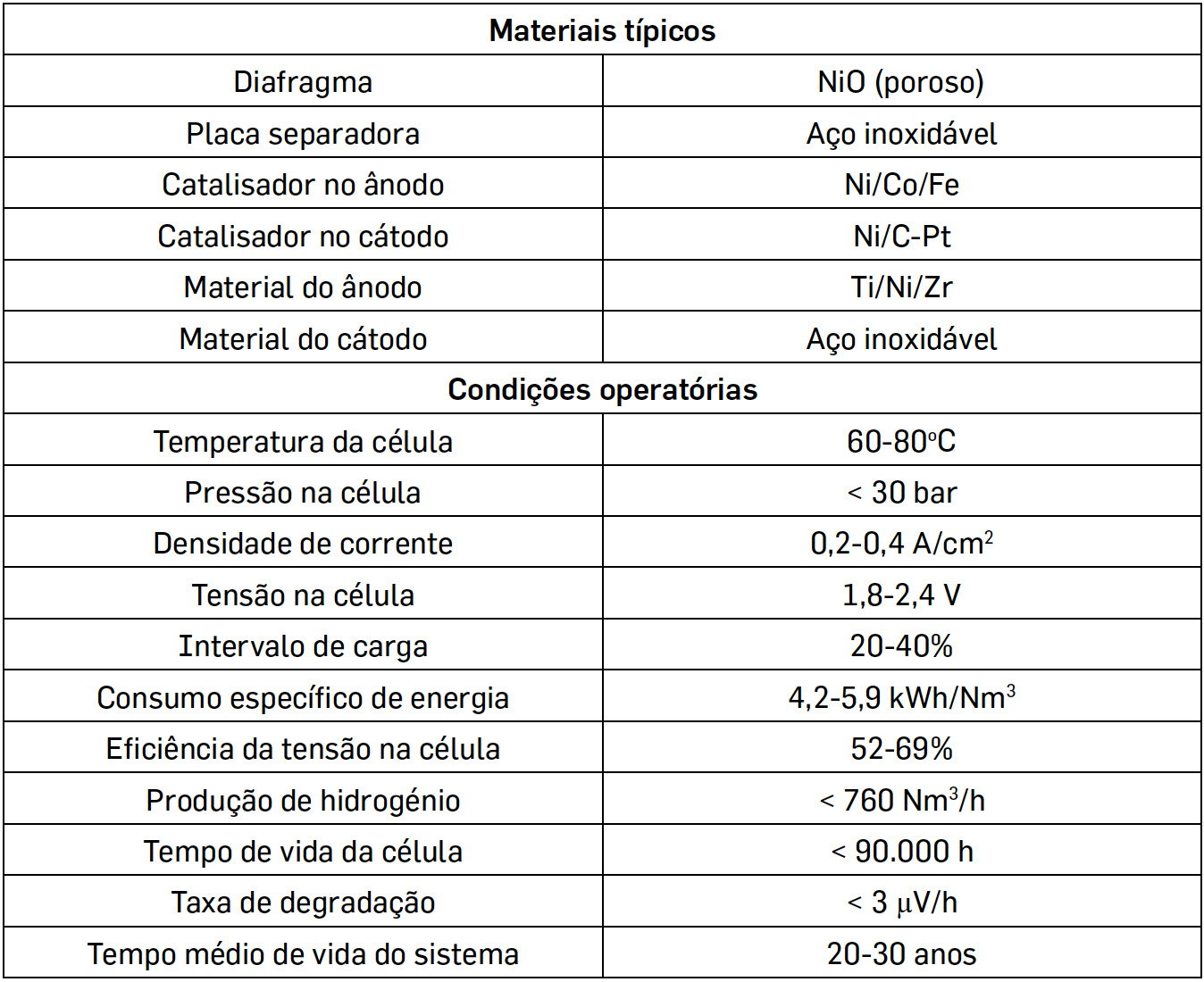
Em que é notório que o volume do hidrogénio produzido é o dobro do volume do oxigénio produzido. Como se sabe, a decomposição da água não é um processo favorável, em termos termodinâmicos, sendo que o potencial padrão de uma célula eletrolítica é de -1,229 V a 25 oC. Contudo, o processo é controlado cineticamente e existem resistências várias devidas à energia de ativação, difusão e mobilidade dos iões, resistência dos condutores, fenómenos de superfície que resultam na formação de bolhas e entropia, o que faz com que o potencial necessário para vencer estes fatores tenha que ser superior, o que se denomina por sobrepotencial. No que diz respeito a eletrólitos, prefere-se, geralmente, a eletrólise em meio alcalino por ser mais eficiente do que a eletrólise em meio ácido[5], utilizando potassa cáustica ou soda cáustica, sendo os elétrodos separados por um diafragma, o que permite a separação dos 2 gases obtidos, sendo ainda possível utilizar catalisadores para melhorar a eficiência.
Na TABELA 1 indicam-se as principais especificações e condições operatórias de eletrólise alcalina que constituem o atual estado da arte[6], [7].
De registar a existência das células PEM (Proton Exchange Membrane), introduzidas pela General Electric, em 1960, para obviar algumas desvantagens da eletrólise alcalina. As células PEM são células equipadas com um eletrólito sólido polimérico responsável pela condução de protões, separação dos produtos gasosos e isolamento elétrico dos elétrodos, como se representa na FIGURA 2.
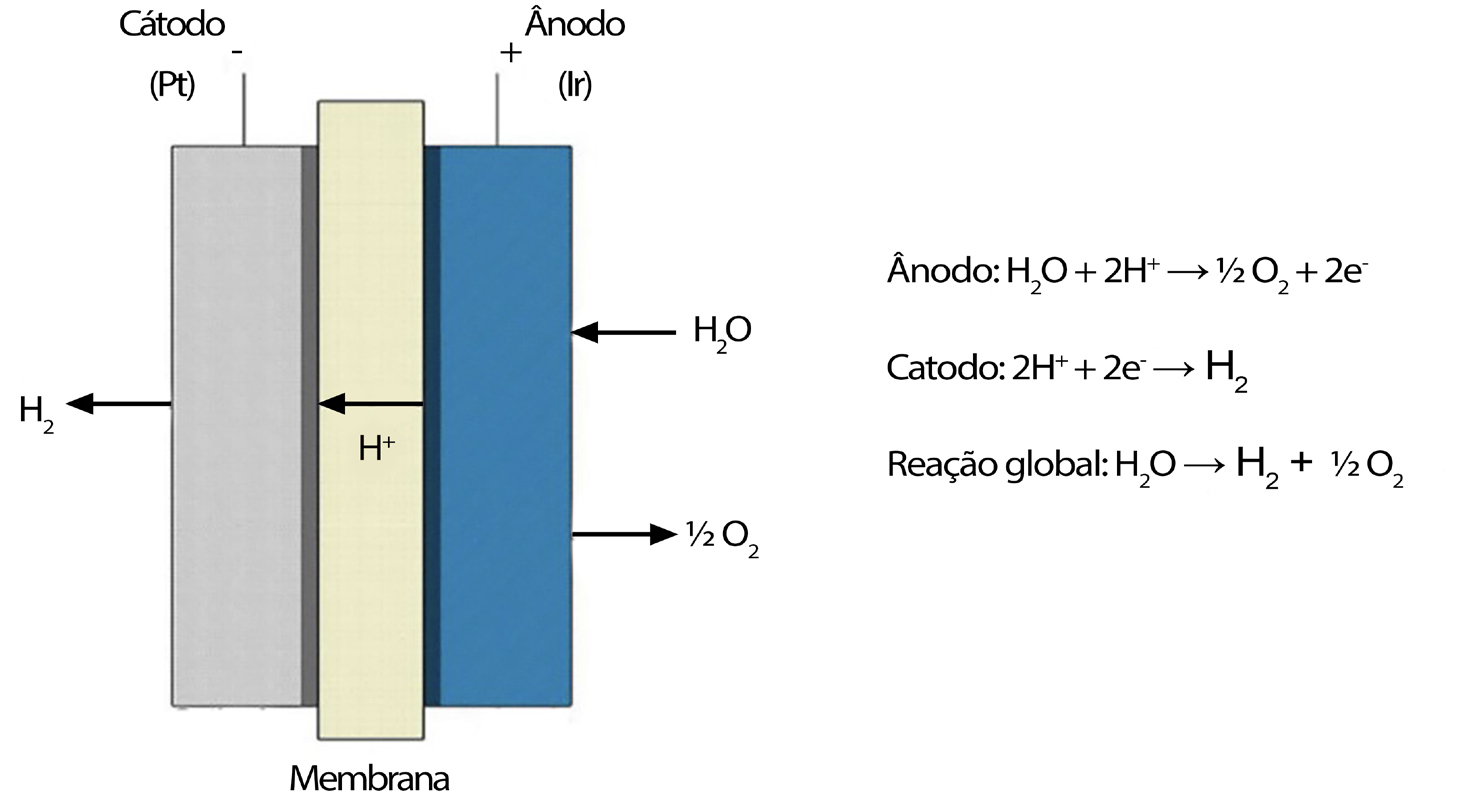
Permite operar com altas densidades de corrente, reduzindo os custos de operação, principalmente em sistemas acoplados a energia eólica ou solar. A sua eficiência atual é de cerca de 80%, esperando-se vir a poder atingir 82-86% antes do ano 2030<[8]. A maior potência atual para unidades PEM é, em 2021, de 20 MW[9]. Contudo, há que notar que a eletrólise alcalina apresenta ainda algumas vantagens em relação à eletrólise PEM, nomeadamente, a utilização de catalisadores mais baratos em relação aos catalisadores usados nos sistemas PEM que são metais do grupo da platina; maior durabilidade devido à possibilidade de renovar o eletrólito e havendo uma menor dissolução do catalisador anódico, além de uma maior pureza do gás obtido, devido à baixa difusividade do gás no eletrólito alcalino.
Como se sabe, a principal desvantagem da eletricidade é que tem que ser consumida automaticamente assim que se faz a sua ligação á rede, sendo algo limitadas as formas de armazenagem em grandes quantidades. Esta está, na maior parte dos casos, circunscrita a formas indiretas como sejam a acumulação de água em albufeiras por sistemas de bombagem reversíveis, nas horas de vazio, em que se faz, na realidade, a acumulação de energia sob a forma de energia mecânica potencial. A outra principal alternativa consiste na conversão de energia elétrica proveniente de fontes renováveis, tais como eólica ou solar, gerada em períodos em que as redes estejam saturadas, a hidrogénio, por eletrólise de água. Neste último caso, a acumulação de energia faz-se de forma química, uma vez que o hidrogénio verde tanto pode ser consumido como energia térmica descarbonizada, como convertida a uma grande diversidade de compostos químicos, o que constitui uma fileira que abre imensas possibilidades para a indústria química de base ao poder ver-se privada do abastecimento de matérias-primas de origem fóssil. Note-se que estas possibilidades de acumulação (indireta) de energia elétrica constituem uma excelente complementaridade para redes como a nacional que tem uma grande incorporação de equipamentos de geração tanto solar como eólica que, como se sabe, debitam energia para a rede, muitas vezes em períodos em que a rede, ou suas interconexões, estão saturadas e que correspondem a inputs nulos em termos de cash-flow[10].
Além disso, merece menção a possibilidade de utilização de células de combustível (fuel cell) como uma tecnologia complementar à eletrólise e que permite reutilizar o hidrogénio para produzir energia elétrica[12].
Pelo exposto, o processo de eletrólise de água, no contexto atual de descarbonização da economia não pode senão ser considerada como uma tecnologia fundamental ao permitir uma conversão eficiente de energia e seu armazenamento.
Desenvolvimentos recentes
Têm-se verificado desenvolvimentos recentes, tanto no campo da otimização dos parâmetros operacionais e scale-up das unidades de eletrólise[13], como de algumas variantes processuais como sejam, a eletrocatálise[14] e a co-eletrólise[15].
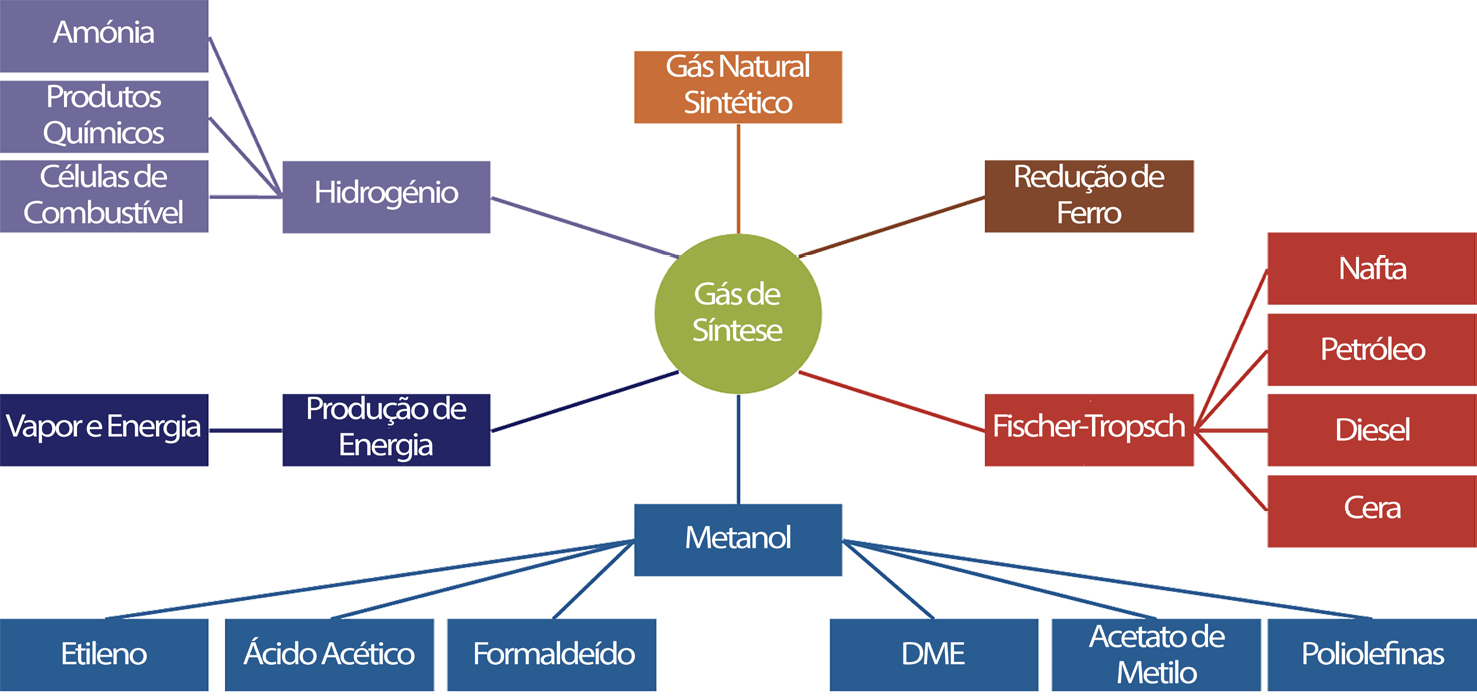
Em particular, e no que diz respeito à co-eletrólise, será interessante mencionar uma patente nacional[16] em que a eletrólise se faz numa célula, com empilhamento de elétrodos, sem membrana separadora de gases e com a adição de uma fonte de carbono (ou utilizando elétrodos de grafite ou usando uma fonte adicional), obtendo-se, assim um gás de síntese, composto maioritariamente por CO, CO2, O2, H2 e CH4. A prova de conceito desta tecnologia foi feita ao abrigo de um projeto de I&D nacional, subsidiado pelo programa COMPETE (Projeto SYM, N.º 38940), com a participação de instituições de investigação e de ensino superior nacionais (FEUP, ISEL e ISQ). O gás de síntese foi inicialmente obtido num protótipo laboratorial de célula aberta[17]. Combinando este princípio base com um sistema catalítico foi possível melhorar a composição do gás de síntese, recorrendo ao processo de Sabatier e, posteriormente, desenvolver a obtenção de uma série de produtos químicos orgânicos, quer líquidos, quer gasosos, que podem ser utilizados como combustíveis ou então permitir a obtenção desses mesmos compostos para processamentos posteriores, energéticos ou não, como, por exemplo, em síntese química[18], sendo que a fonte de biomassa que tem vindo a ser testada com sucesso, é biomassa liquefeita, proveniente de uma tecnologia de liquefação de resíduos florestais lenhosos (desenvolvida pelo IST)[19], num protótipo de 1 kW. Este foi o ponto de partida que está, atualmente, a ser investigado no âmbito do projeto Clean Forest: PCIF/GVB/0167/2018, subsidiado pela Fundação da Ciência e Tecnologia, e que considera, assim, a valorização dos resíduos florestais na perspetiva dupla da prevenção de incêndios e na produção de bioenergia sustentável e competitiva para as regiões do interior. Este projeto resultou, já, no scale-up de um protótipo à escala piloto, com uma capacidade de 100 kW, que se encontra em fase de testes com bons resultados, permitindo obter uma série de compostos químicos de grande interesse energético e industrial a partir de fontes renováveis (biometano, biometanol, bio-DME, biodiesel, etc.), conforme se indica na FIGURA 3.
Notas finais
É grato verificar que uma tecnologia como a eletrólise de água, que resultou na implementação de unidades industriais em território nacional nas décadas de 40 e 50 do século passado, na sequência de um período intenso de eletrificação do país, não só volta a estar na ordem do dia, beneficiando de muito conhecimento acumulado, mas ainda de desenvolvimentos recentes que têm vindo a ser feitos em Portugal como resultado de colaboração entre a indústria e entidades de investigação de ensino superior. No interesse da criação de valor para a indústria nacional, resultante da implementação da tecnologia de obtenção do hidrogénio verde, a indústria nacional poderá vir a desenvolver tecnologia própria a adotar no âmbito da atual drive de descarbonização da economia, contribuindo para o ultrapassar das limitações tecnológicas atualmente existentes.
Referências
- ↑ DIAS, J., Linhas de rumo, Notas de Economia Portuguesa, 1. 1945.
- ↑ BUSTORFF, A. et al., Improvement of efficiency in the electrolysis of water by overvoltage reduction at the electrodes, Paper 76, World Power Conference, Lausanne. 1964.
- ↑ SANTOS, J. & GOMES, J., Condutividade de soluções aquosas de hidróxido e carbonato de sódio, Técnica, 337,439-451. 1964.
- ↑ AMARAL, L., As eólicas e a bombagem, Expresso. 2021.
- ↑ SCHALENBACH, M. et al., Acidic or Alkaline? Towards a New Perspective on the Efficiency of Water Electrolysis, Journal of the Electrochemical Society, 163, 11. 2016.
- ↑ CARMO, M. et al., A comprehensive review on PEM water electrolysis, Journal of Hydrogen Energy, 38, 12, 4901. 2013.
- ↑ GONI-URTIAGA, A. et al., Solid acids as electrolyte materials for PEM electrolysis, International Journal of Hydrogen, 37, 3358. 2012.
- ↑ BERNHOLZ, J., RWE’s former, current and possible future energy storage applications, VGB Kongress & IEKE Workshop. 2018.
- ↑ COLLINS, L., World’s largest green-hydrogen plant inaugurated in Canada by Air Liquide, Latest renewable energy news. 2021.
- ↑ AMARAL, L., As eólicas e a bombagem, Expresso. 2021.
- ↑ CARMO, M. et al., A comprehensive review on PEM water electrolysis, Journal of Hydrogen Energy, 38, 12, 4901. 2013.
- ↑ RAMBABU, G. et al., Carbon nanocomposite membrane electrolysis for direct methanol fuel cells: a concise review, Nanomaterials, 9, 9. 2019.
- ↑ DANILOVIC, N. et al., Challenges in Going from Laboratory to Megawatt Scale PEM Electrolysis, ECS Transactions, 75, 395. 2016.
- ↑ DUROVIC, M. et al., Electrocatalysts for the hydrogen evolution reaction in alkaline and neutral media. A comparative review, Journal of Power Sources, 493, 229708. 2021.
- ↑ ZHENG, Y. et al., A review of high temperature co-electrolysis of H2O and CO2 to produce sustainable fuels using solid oxide electrolysis cells (SOECs): advanced materials and technology, Chemical Society Reviews, 46, 1427-1463. 2017.
- ↑ RODRIGUES, J., Obtenção de gás de síntese por eletrólise alcalina de água, Patente Portuguesa. 2013.
- ↑ GUERRA, L. et al., Preliminary study of synthesis gas production from water electrolysis using the ELECTROFUEL concept, Energy, 89, 1050-1056. 2015.
- ↑ GONÇALVES, A. et al., Towards the development of syngas/biomethane electrolytic production using liquefied biomass and heterogeneous catalyst, Energies, 12, 3787. 2019.
- ↑ MATEUS, M. et al., Potential biofuel from liquefied cork – Higher heating value comparison, Fuel, 174, 114-117. 2016.
Criada em 7 de Outubro de 2021
Revista em 13 de Janeiro de 2022
Aceite pelo editor em 15 de Junho de 2022
