Cátodo
Referência : Lima, L.S., (2015) Cátodo, Rev. Ciência Elem., V3(1):018
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.018]
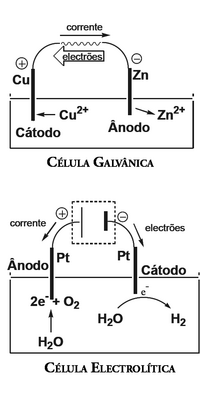
O cátodo é o eléctrodo de uma célula electroquímica onde se dá a redução de uma espécie química. Como a espécie que sofre redução necessita de electrões e é o ânodo que os fornece, o fluxo de electrões tem origem no ânodo e dirige-se para o cátodo, pelo que a corrente eléctrica tem o sentido oposto (do cátodo para o ânodo).
O cátodo, tal como o ânodo, pode ter sinal positivo ou negativo, conforme a célula electroquímica seja galvânica ou electrolítica, respectivamente. No caso de uma célula galvânica, a reacção de oxidação-redução dá-se de forma espontânea. Assim, os iões presentes na solução de electrólito onde está mergulhado o cátodo migram para a sua superfície onde sofrem redução, depositando-se sobre este. Como o cátodo tem deficiência de electrões, adquire uma polaridade positiva. Já numa célula electrolítica, ocorre a reacção de oxidação-redução inversa, devido a uma fonte de tensão que é introduzida no circuito, cuja diferença de potencial origina uma intensidade de corrente no sentido oposto de uma célula galvânica. Por isso, a oxidação passa a ocorrer no eléctrodo onde antes ocorria a redução e vice-versa. Assim, o cátodo passa a ter sinal negativo.
A palavra cátodo deriva do grego káthodos (katá, “para baixo” + odós, “caminho”), que significa descida (sentido descendente dos electrões). Tal como no caso do ânodo, a palavra cátodo foi criada em 1834 por William Whewell, um polímato, cientista, padre anglicano, filósofo, teólogo e historiador de ciência inglês do final do século XVIII e século XIX. Contudo, foi Michael Faraday, físico e químico inglês seu contemporâneo, quem utilizou e popularizou o termo após ter solicitado a Whewell novas terminologias para a descrição do processo de electrólise por ele descoberto.
O fenómeno da deposição de material (um metal, por exemplo) na superfície do cátodo como consequência da reacção de redução conduziu ao desenvolvimento da técnica denominada electrodeposição. Esta consiste na deposição electroquímica de uma camada de um metal sobre um material, conferindo-lhe propriedades diferentes do material original. Neste caso, o material que vai sofrer a deposição constitui o próprio cátodo. Um exemplo desta técnica é a vulgarmente designada “cromagem”, onde é depositada uma fina camada de crómio metálico no material para prevenir a corrosão, aumentar a dureza da superfície, facilitar a limpeza ou, simplesmente, funcionar como peça decorativa.
Criada em 05 de Janeiro de 2010
Revista em 05 de Janeiro de 2011
Aceite pelo editor em 08 de Janeiro de 2011