Como criar um novo fármaco
Referência : Oliveira, A., (2020) Como criar um novo fármaco, Rev. Ciência Elem., V8(2):020
Autor: Ana Oliveira
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2020.020]

Aproveitando o esforço mundial para a criação de fármacos para a COVID-19, explica-se a estratégia seguida para a criação de um novo fármaco. A fase inicial do desenvolvimento assenta sobretudo na especificidade das propriedades e das interações químicas entre o fármaco e o seu alvo terapêutico. Depois, o fármaco é sujeito a uma fase de validação e várias fases de testes clínicos que começam em modelos animais, até à administração do fármaco no doente, atingindo assim a forma de medicamento.
Como atua um fármaco?
Os fármacos são compostos químicos, que podem ser sintetizados em laboratório ou extraídos de produtos naturais, e que foram especificamente desenvolvidos para prevenir, diagnosticar ou curar doenças. O fármaco é o composto ativo de um medicamento.
O processo de descoberta de um fármaco é bastante complexo, ele envolve três grandes áreas: da biologia a proteómica, da química os químicos computacionais e químicos de síntese, e da farmacologia as técnicas bioquímicas para a sua avaliação laboratorial.
Existem três classes de alvos farmacológicos: DNA, RNA e proteínas, sendo que as proteínas são o alvo mais comum. As proteínas são designadas de recetores se recebem e traduzem os sinais celulares, ou enzimas se forem catalisadores biológicos.
Em farmacologia os fármacos são classificados de agonistas se eles estimulam a resposta de um recetor. Em contraste, um fármaco é designado de antagonista se ele bloqueia a ação do recetor. Além dos recetores, as enzimas são grandes alvos terapêuticos porque elas executam os principais processos bioquímicos dos organismos vivos. As enzimas têm uma cavidade específica — centro ativo — onde se une o seu substrato. Esse encaixe do substrato deve-se às interações químicas entre o substrato e as cadeias laterais dos aminoácidos que compõem o centro ativo. Quando o alvo terapêutico é uma enzima e a sua função fica impedida pela união de um fármaco, este é chamado de inibidor. Em geral, o inibidor compete com o substrato natural para ocupar o sítio ativo da enzima.
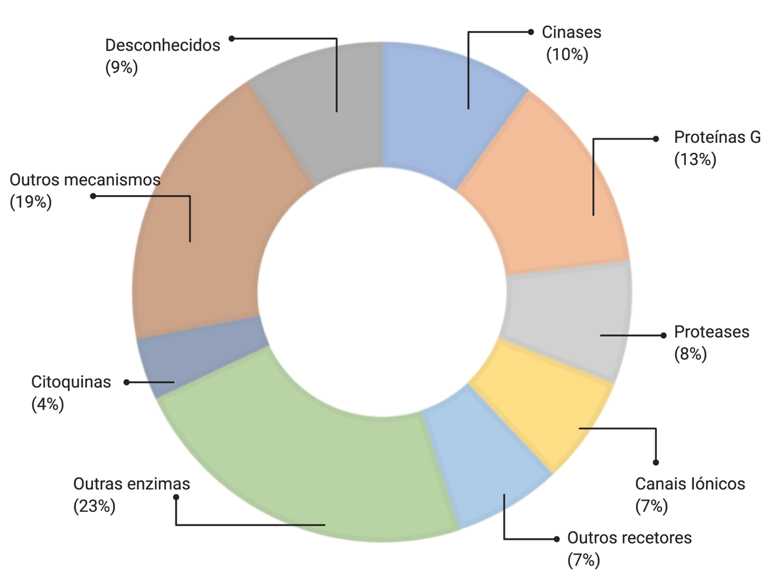
A grande maioria dos fármacos que existem disponíveis no mercado têm como alvo terapêutico recetores membranares (27%) e enzimas (~30%), nomeadamente cinases (10%) e proteases (8%)[1] (FIGURA 1).
Como se descobrem novos fármacos?
Nem todos os alvos biológicos podem unir fármacos. Assim, a primeira fase do desenvolvimento dos novos fármacos pretende entender as propriedades do alvo em estudo, i.e., é necessário determinar se o alvo exibe uma cavidade para a união de pequenas moléculas orgânicas ou biológicas, que por sua vez, possam modular a função terapêutica do alvo. A efetividade de um fármaco depende das interações químicas específicas entre o fármaco e o seu alvo. Por outro lado, o fármaco pode apresentar dimensões muito variadas, desde um pequeno composto, com peso molecular até 500g/mol, até um polipéptido.
O primeiro passo de um projeto de descoberta de novos fármacos consiste em reunir toda a informação bibliográfica sobre o alvo em questão, principalmente a sua função e mecanismo de ação. Neste passo dá-se particular interesse à estrutura tridimensional da proteína ou ácido nucleico (DNA ou RNA), responsável pela função. Estas estruturas, obtidas principalmente por técnicas como a Cristalografia de Raios X (X-Ray), Microscopia Eletrónica (cryo-EM) ou a Ressonância Magnética Nuclear (NMR), fornecem informação acerca do enovelamento das proteínas, das propriedades químicas do alvo, do tamanho das cavidades para unir fármacos e ainda sobre a facilidade ou dificuldade de um fármaco aceder a estes locais de união.
O sucesso da descoberta de novos fármacos depende essencialmente do reconhecimento molecular deste composto para o seu alvo.
Nos últimos anos, com o aumento das capacidades computacionais e o desenvolvimento de supercomputadores, têm-se vindo a usar, cada vez mais frequentemente, técnicas computacionais como o encaixe molecular e a triagem molecular para acelerar o processo de descoberta de novos fármacos e explorar a sua forma de união[2].
As técnicas de encaixe molecular prevêem as interações moleculares entre o fármaco e o alvo. Estas interações químicas como as ligações covalentes, as interações eletrostáticas: iónicas, ião-dipolo, dipolo-dipolo, ligações de halogénio e interações pontes de hidrogénio (principais aceitadores e dadores de eletrões), e ainda as fortes interações hidrofóbicas, tal como as interações de Pi stacking e as forças de dispersão de van der Walls determinam o grau de afinidade do alvo para o fármaco e desta forma modulam a função do alvo.
Por outro lado, as técnicas computacionais permitem testar milhões compostos, de uma forma muito mais económica e rápida que os convencionais ensaios de laboratório, tornando- se assim ferramentas fundamentais na descoberta de novos fármacos.
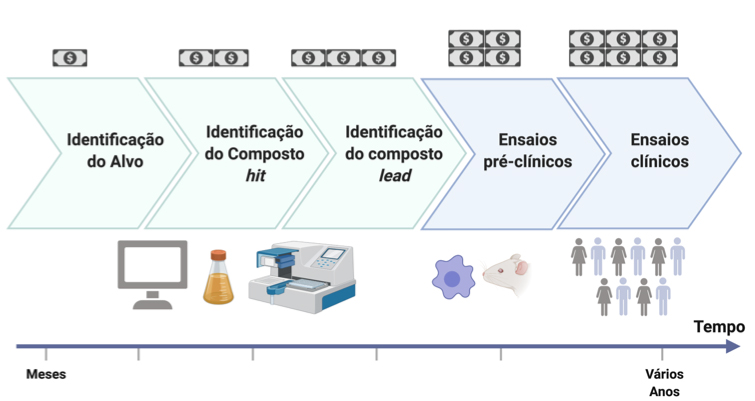
Este rastreio de milhões de compostos para o seu alvo vai permitir ordenar os compostos com base na sua afinidade. Os compostos que melhor interagem são selecionados para serem comprovados por técnicas experimentais bioquímicas. Para aumentar as hipóteses de encontrar um novo fármaco, os cientistas costumam testar cerca de 100 compostos que exibam diferentes propriedades químicas. Quando a união de um destes 100 compostos à proteína é validada por técnicas da bioquímica experimental, a este composto dá-se o nome de hit. Em geral, os compostos hit unem o alvo em concentrações micromolares. Depois, os químicos computacionais e químicos de síntese cooperam de forma a modificar o composto hit, i.e., substituem pequenos grupos químicos para poder melhorar a complementaridade entre o alvo e o composto. Estes compostos designam-se de lead. Os compostos lead unem com mais especificidade e assim podem requerer menores concentrações (nanomolar ou picomolar). Nesta fase, cabe ao cientista responsável identificar se o composto lead pode ainda ser otimizado para passar então a uma fase de testes pré-clínicos, que está sobretudo composta por ensaios em células e pequenos animais (FIGURA 2).
O que está a ser testado para a COVID19
A comunidade científica tem dado particular atenção a dois alvos terapêuticos no combate à COVID-19. Uma das abordagens tem como objetivo impedir a entrada do vírus SARS-CoV-2, causador da doença, no humano. A infeção do vírus ocorre quando uma das proteínas da camada superficial do vírus — proteína de espícula — encontra as proteínas da enzima ACE2 humana[3], [4]. Esta enzima, uma metalocarboxilase, desempenha um papel importante nos mecanismos de prevenção da oxidação celular e ainda no controlo de hipertensão. O que se pretende é encontrar um fármaco que impeça o contacto entre as duas proteínas, nomeadamente, o desenho de um polipéptido que impeça que as duas proteínas possam interagir entre si.
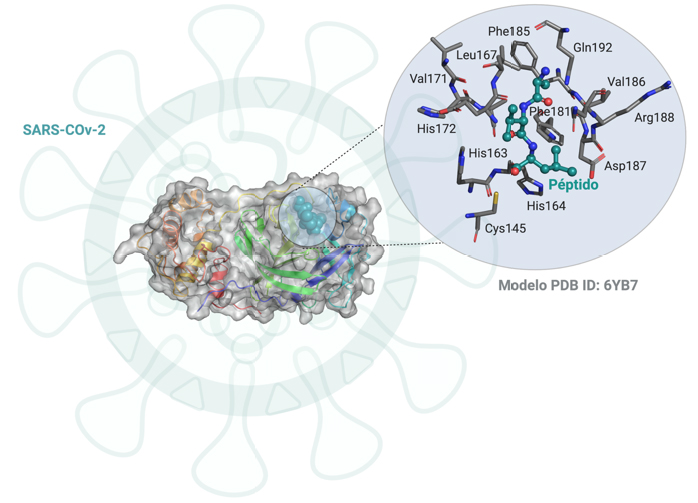
Uma outra abordagem, tem como objetivo determinar o mecanismo de ação da protease principal do vírus SARS-CoV-2 e desenhar um fármaco específico que iniba a ação da enzima. A protease principal do vírus é uma enzima fundamental para a sua sobrevivência no hospedeiro humano[5] (FIGURA 3). Esta enzima é responsável pela síntese de novas proteínas virais, sem as quais este não consegue replicar-se. Desta forma, o bloqueio da ação da enzima, levará à inativação do vírus.
Através de técnicas de triagem molecular pretende identificar-se, entre centenas de milhões de compostos químicos, aqueles que apresentam melhor complementaridade de forma e que exibem atrações químicas mais fortes entre o fármaco e a protease. Os cientistas querem apresentar uma lista de compostos inibidores da protease principal do vírus, com potencial para servirem de base para o desenvolvimento de fármacos para tratar as infeções pelo vírus.
Ainda nesta linha de investigação e com o objetivo de bloquear função da principal protease do SARS-CoV-2, estão a ser testados medicamentos que são atualmente comercializados, também estão a ser testados medicamentos que com o passar dos anos foram retirados do mercado, e ainda fármacos numa fase avançada de investigação. Esta estratégia de reutilização tem como principal vantagem acelerar o processo de descoberta de fármacos porque já se dispõe de informação sobre a sua segurança, toxicidade, e comportamento no organismo sobre eles e, como desvantagem, reduz-se o espaço químico de busca a poucos milhares de compostos químicos.
Como se aprova um fármaco?
Para um fármaco se tornar medicamento, e chegar a ser comercializado, ele é sujeito a três grandes fases de testes clínicos, havendo ainda uma quarta fase de testes clínicos que começa após a comercialização. Em média, para que um fármaco chegue à fase de comercialização, são testados até 10 mil compostos nas fases iniciais. Este longo processo dura, em geral, entre 10 a 15 anos.
Numa primeira fase, avalia-se a segurança e a tolerância do novo fármaco em indivíduos saudáveis. É aqui que se avalia a forma como se pode administrar o fármaco, a forma como ele se distribui no corpo, se é metabolizado e depois excretado. Estas propriedades designam-se de propriedades ADME (na língua inglesa, administration, distribution, metabolism and excretion).
Numa segunda fase, pretende-se avaliar a eficácia terapêutica. É nesta fase que o fármaco pode ser administrado em centenas indivíduos portadores de doença, e se determina a dose para a qual o fármaco é eficaz para a resposta esperada.
Depois, na terceira fase, demonstra-se o benefício do fármaco, comparando os seus efeitos em milhares de indivíduos saudáveis e doentes, e se se confirma então uma ação positiva de um fármaco pode obter-se uma autorização para a sua introdução no mercado, passando a ser designado de medicamento. Por fim, na fase quarta, otimiza-se do uso do medicamento, verifica- se a sua interação com outros medicamentos e avaliam-se quais os novos efeitos secundários. Assim, o fármaco pode, se necessário, ser reformulado e vendido a uma ampla população. Existem duas grandes agências que regulam a eficácia clínica e a segurança na administração de um medicamento: a EMA — Agência Europeia do Medicamento — e a FDA — Food and Drug Administration nos Estados Unidos da América. Estas agências são responsáveis por avaliar os riscos e benefícios dos medicamentos de acordo com os relatórios dos testes clínicos[6].
No entanto, e dependendo da carga genética de cada indivíduo, os medicamentos têm efeitos positivos e negativos e por isso é necessário, também, um estudo aprofundado sobre a genética da população de cada país — o fenótipo. Neste contexto, e apesar de haver uma entidade europeia responsável pela aprovação dos fármacos, cada país têm uma entidade que regula a sua administração. Em Portugal o INFARMED é responsável pela regularização dos medicamentos tendo em conta o fenótipo dos Portugueses.
A Organização Mundial da Saúde (OMS) tem também um papel fundamental na escolha e aprovação dos medicamentos, a agência disponibiliza uma lista de medicamentos e diagnósticos que são considerados essenciais. Esta lista inclui os medicamentos que os países devem ter sempre disponíveis com vista a evitar as doenças de maior incidência, como por exemplo o cancro e doenças infeciosas e, assim, evitar catástrofes globais de saúde[7].
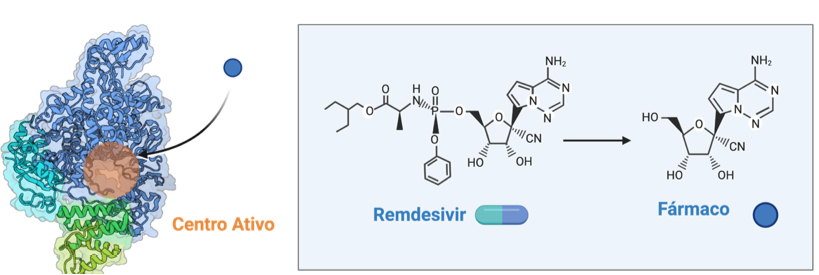
A 1 de Maio de 2020, a FDA aprovou um plano de emergência para aprovar a administração do primeiro medicamento contra a COVID-19, em doentes graves. Este medicamento antiviral, o Remdesivir, tinha sido desenvolvido para combater o vírus Ébola e estava atualmente a ser testado em fase dois[8]. A estrutura química do fármaco pode ser observada na FIGURA 4.
No entanto, até à data deste artigo, não se conhece nenhum fármaco específico para combate à pandemia, e nenhum que reúna todas as condições de segurança para ser administrado.
Referências
- ↑ SANTOS, R. et al. A comprehensive map of molecular drug targets, 2017.
- ↑ SLIWOSKI, G. et al. Computational Methods in Drug Discovery, Pharmacol. Rev. Pharmacol Rev, vol. 66, pp. 334–395, 2014.
- ↑ LI, F. et al. Structural biology: Structure of SARS coronavirus spike receptor-binding domain complexed with receptor, (80-. )., vol. 309, no. 5742, pp. 1864–1868, Sep. 2005.
- ↑ Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor | Nature. 2020
- ↑ ZHANG, et al. Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved ?-ketoamide inhibitors, Science. 2020.
- ↑ Development & Approval Process | Drugs | FDA, 2020.
- ↑ The Selection and Use of Essential Medicines The Selection and Use of Essential Medicines WHO Technical Report Series
- ↑ WANG, Y. et al. Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial, Lancet, vol. 0, no. 0, pp. 1569–1578. 2020.
Recursos relacionados disponíveis na Casa das Ciências:
Criada em 19 de Maio de 2020
Revista em 20 de Maio de 2020
Aceite pelo editor em 22 de Junho de 2020
