Combustão
Referência : Ribeiro, D., (2014) Combustão, Rev. Ciência Elem., V2(2):171
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.171]

Uma combustão é uma reação química em que uma substância reage com dioxigénio, resultando, geralmente, libertação de calor e emissão de radiação.1 Numa combustão, a substância combustível reage com a substância comburente originando diversos produtos de combustão.
A combustão, vulgarmente designada queima (embora erradamente), de substâncias ricas em carbono é, desde há milhares de anos, a fonte de energia mais utilizada pelo ser humano. No entanto, os fenómenos de combustão libertam gases que aumentam o efeito de estufa e, por isso, atualmente estão a fazer-se cada vez mais esforços para minimizar a produção de energia a partir da combustão. No entanto, presentemente, mais de 50%[2] da energia elétrica produzida mundialmente resulta de processos de combustão (centrais térmicas ou termoelétricas).
A utilização doméstica de hidrocarbonetos, como os GLP propano e butano e o gás natural (principalmente constituído por metano) estão bastante generalizadas. Estes hidrocarbonetos, por combustão, originam dióxido de carbono e água:
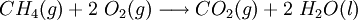
Estas combustões, são casos particulares de reações de oxidação-redução. No caso da reação em destaque, o número de oxidação do oxigénio varia de 0 para -2, o que corresponde a uma redução (o dioxigénio actuou como oxidante).
Outra reação de oxidação-redução da qual estamos totalmente dependentes é a metabolização da glicose. É a partir desta reação química que o nosso corpo obtém energia
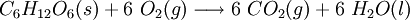
As combustões podem ser completas ou incompletas. As combustões completas ocorrem quando existe oxigénio em excesso e, por isso, a reação de combustão dá-se conforme previsto nas equações químicas acima. No entanto, quando o processo de combustão decorre com um défice de oxigénio, outros produtos de reação poderão ser formados (por exemplo, na combustão incompleta de hidrocarbonetos, um dos produtos de reação pode ser o carbono, sob a forma de fuligem – ver figura 1).
Referências
- R. Chang, Chemistry, 10th edition, Boston: McGraw-Hill, 2010, ISBN: 978-0-07-351109-2.
- IEA Energy Statistics: Electricity generation by fuel – Portugal, consultado em 07/11/2011.
- Wikimedia Commons: Diesel smoke, consultado em 09/11/2011.
Criada em 10 de Fevereiro de 2012
Revista em 27 de Fevereiro de 2012
Aceite pelo editor em 09 de Março de 2012

