Auto-ionização da água
Referência : Lima, L.S., (2013) Auto-ionização da água, Rev. Ciência Elem., V1(1):068
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2013.068]

A auto-ionização da água consiste na transferência de um protão entre duas moléculas de água com formação dos iões hidróxido (OH-) e oxónio (H3O+). A transferência é possível pelo facto de a água ser uma substância anfotérica, isto é, poder actuar como ácido e como base. A equação que ilustra a reacção de auto-ionização da água é a seguinte:
2 H2O(l) |
 |
H3O+(aq) |
+ |
HO-(aq) |
A água desionizada, apesar do nome, contém os iões resultantes da sua auto-ionização.
O número de aniões hidróxido formados é igual ao número de catiões oxónio, pelo que, em água pura, a sua concentração é igual: [H3O+] = [OH-] = 1,0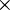 10-7 mol
10-7 mol dm-3, a 298 K (25 ºC) e a 105 Pa (1 bar). Quando [H3O+] = [OH-], a água diz-se neutra (em termos ácido-base), sendo esta a única condição que define neutralidade. Daqui resulta que o valor do pH da água neutra é 7,0 à temperatura de 298 K e à pressão de 105 Pa.
dm-3, a 298 K (25 ºC) e a 105 Pa (1 bar). Quando [H3O+] = [OH-], a água diz-se neutra (em termos ácido-base), sendo esta a única condição que define neutralidade. Daqui resulta que o valor do pH da água neutra é 7,0 à temperatura de 298 K e à pressão de 105 Pa.
A constante de equilíbrio desta reacção é definida da seguinte forma:
![K_\text{w} = [\text{H}_3\text{O}^+] [\text{OH}^-]](/wiki/images/math/6/f/a/6fa55795430269ede5c76f3b8478e4b9.png)
em que Kw representa a constante de auto-ionização da água, também denominada produto iónico da água. A 298 K (25 ºC) e a 105 Pa (1 bar), Kw = 1,0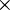 10-14. A temperatura tem uma influência considerável na extensão da reacção de auto-ionização da água, ao contrário da influência da pressão, que é praticamente nula. Quanto maior for a temperatura maior é a extensão da reacção, o que significa que a concentração dos iões H3O+ e HO- é maior e, por conseguinte, menor é o valor de pH da água neutra e maior é o valor de Kw. Por exemplo, a 323 K (50 ºC) e a 105 Pa, Kw = 5,5
10-14. A temperatura tem uma influência considerável na extensão da reacção de auto-ionização da água, ao contrário da influência da pressão, que é praticamente nula. Quanto maior for a temperatura maior é a extensão da reacção, o que significa que a concentração dos iões H3O+ e HO- é maior e, por conseguinte, menor é o valor de pH da água neutra e maior é o valor de Kw. Por exemplo, a 323 K (50 ºC) e a 105 Pa, Kw = 5,5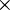 10-14 [1], logo [H3O+] = [HO-] = 2,3
10-14 [1], logo [H3O+] = [HO-] = 2,3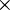 10-7 mol
10-7 mol dm-3, ou seja, para água pura neutra a esta temperatura e pressão, pH = 6,6. Para soluções de concentrações moderadas, o valor de Kw indica os valores mínimo e máximo de [H3O+] para uma determinada temperatura, isto é, impõe os limites na escala de pH. A 298 K, o valor máximo de pH é 14, enquanto a 323 K o valor máximo de pH é 13.2.
dm-3, ou seja, para água pura neutra a esta temperatura e pressão, pH = 6,6. Para soluções de concentrações moderadas, o valor de Kw indica os valores mínimo e máximo de [H3O+] para uma determinada temperatura, isto é, impõe os limites na escala de pH. A 298 K, o valor máximo de pH é 14, enquanto a 323 K o valor máximo de pH é 13.2.
Referências
1. A. V. Bandura, S. N. Lvov, J. Phys. Chem. Ref. Data 35 (2006) 15-30.
Criada em 17 de Dezembro de 2010
Revista em 17 de Dezembro de 2010
Aceite pelo editor em 17 de Dezembro de 2010
