Aminoácido
Referência : Fernandes, R.F., (2015) Aminoácido, Rev. Ciência Elem., V3(3):176
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.176]
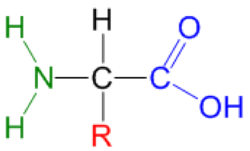
Um aminoácido é uma substância cuja molécula contém os grupos funcionais - amino (-NH2) e carboxilo (-COOH). Num α-aminoácido existe um substituinte na posição 2 (R), que pode ser uma cadeia alquílica ou arílica, podendo conter um dos seguintes grupos: hidroxilo, amino, mercapto, sulfureto, carboxilo, guanidininilo ou imadazolilo (figura 1).
O primeiro aminoácido natural a ser descoberto, a asparagina, foi isolado a partir do espargo (Asparagus officinalis), em 1806, pelos químicos franceses Louis Nicolas Vauquelin (1736-1829) e Pierre Jean Robiquet (1780-1840). Posteriormente, em 1810, foi descoberto o aminoácido cistina, que mais tarde, em 1884, se verificou ser um dímero constituído por duas moléculas de cisteína. À medida que a química orgânica se foi desenvolvendo, novos aminoácidos foram isolados e na actualidade já se identificaram cerca de 700.[1]
Os aminoácidos são compostos anfotéricos, uma vez que a sua estrutura apresenta dois grupos funcionais - amino e carboxilo - que actuam como base e como ácido, respectivamente. Assim, ocorrem transferências de protões dos grupos ácidos para os grupos básicos, formando espécies designadas por iões dipolares ou zwitteriões (do germânico zwitt, que significa ambivalente). A elevada polaridade da estrutura zwitteriónica permite que o aminoácido forme estruturas cristalinas relativamente solúveis em água. Porém, quando aquecidos (473-573 K ou 200-300 ºC), tendem a decompor-se, antes de atingirem a temperatura de fusão.
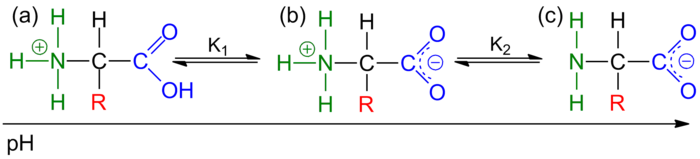
Em solução, os aminoácidos, se não têm cadeias laterais ionizáveis, apresentam dois grupos capazes de sofrer protonação/desprotonação (figura 2). Assim, a carga do aminoácido varia com o pH da solução. A pH baixo o grupo amina encontra-se protonado originando um catião (figura 2a). A pH elevado, apenas o grupo ácido se encontra desprotonado, ficando assim o aminoácido com carga negativa (figura 2c). O pH a que a extensão da protonação é igual à extensão da desprotonação é designando por pH isoeléctrico ou ponto isoeléctrico, que corresponde ao pH em que é máxima a concentração do zwitterião (forma com carga global neutra resultante de duas cargas simétricas - positiva no grupo amino e negativa no grupo carboxílo) (figura 2b).
Figura 2 - As três formas de um aminoácido de acordo com o pH da solução: (a) forma catiónica; (b) forma zwitteriónica; (c) forma aniónica.
Os aminoácidos são extremamente importantes a nível bioquímico, uma vez que são a unidade básica de construção (monómeros) das proteínas, as quais desempenham funções vitais nos organismos como, por exemplo, na respiração celular e no metabolismo. Apesar do elevado número de aminoácidos identificados até à actualidade, apenas cerca de duas dezenas de α-aminoácidos entram na constituição das proteínas de todas as espécies, desde os humanos até às bactérias. No organismo humano, alguns α-aminoácidos são sintetizados pelo próprio organismo, porém, existem 8 α-aminoácidos (fenilalanina, isoleucina, leucina, lisina, metionina, treonina, triptofano e vanilina) que o organismo não consegue produzir, mas indispensáveis para o seu funcionamento. Assim, estes compostos designados por aminoácidos essenciais, necessitam obrigatoriamente de ser incluídos na dieta alimentar humana.
Os aminoácidos apresentam diversas aplicações tecnológicas, sendo principalmente utilizados como aditivos alimentares em rações de animais, uma vez que o componente principal destas é à base de soja ou outras leguminosas similares, que apresentam baixa percentagem de aminoácidos essenciais. Na indústria alimentar o ácido glutâmico é utilizado como um aromatizante.[2] Os aminoácidos são igualmente utilizados como precursores na síntese de alguns medicamentos utilizados, por exemplo, no tratamento da síndrome de Parkinson.
Referências
1. A. Quintas, A. P. Freire, M. J. Halpern, Bioquímica - Organização Molecular da Vida, Lidel: Lisboa, 2008, ISNB: 978-972-757-431-5.
2. S. Garattini, J. Nutrition 130 (2000), 901S-909S Glutamic Acid, Twenty Years Late
INTRODUCING AMINO ACIDS, consultado em 3/06/2010.
Criada em 28 de Setembro de 2010
Revista em 03 de Fevereiro de 2011
Aceite pelo editor em 04 de Fevereiro de 2011