Abaixamento da pressão de vapor
Referência : Lima, L.S., (2014) Abaixamento da pressão de vapor, Rev. Ciência Elem., V2(1):024
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.024]

O abaixamento da pressão de vapor é uma propriedade coligativa das soluções pois depende somente do número de partículas em solução, independentemente da sua natureza.
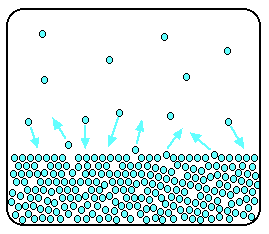
Considere-se um solvente puro (e.g. água destilada). Num sistema fechado e a uma determinada temperatura, as moléculas de solvente podem “escapar” da superfície líquida e passar para a fase gasosa (evaporação); por seu lado, as moléculas da fase gasosa podem regressar à fase líquida (condensação). Quando as velocidades de evaporação e condensação são iguais, a composição das duas fases é constante e a pressão do sistema denomina-se pressão de vapor de saturação (ver figura 1).
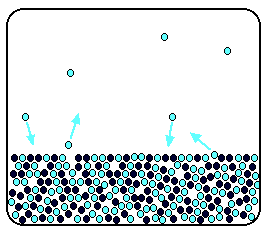
Quando se dissolve um soluto não volátil num solvente puro, forma-se uma solução. As moléculas de soluto dispersam-se por toda a solução, inclusivamente pela superfície. Assim, apenas uma fracção das moléculas à superfície é de solvente, o que diminui a probabilidade de evaporação (ver figura 2). A velocidade de evaporação é tanto menor quanto menor for a fracção de moléculas de solvente na solução. No entanto, a velocidade de condensação não é afectada, pois o número de moléculas de solvente na fase gasosa em contacto com a superfície da solução é independente do número de moléculas de soluto.
Daqui resulta uma efectiva diminuição do número de moléculas no estado gasoso, ou seja, uma menor pressão de vapor da solução relativamente ao solvente puro. Este abaixamento da pressão de vapor é independente da natureza das moléculas de soluto mas depende da quantidade relativa de soluto dissolvido e é traduzido matematicamente pela lei de Raoult:
p solvente = x solvente  p* solvente (1)
p* solvente (1)
Nesta equação, psolvente é a pressão de vapor do solvente em solução, p*solvente é a pressão de vapor do solvente puro e xsolvente é a fracção molar do solvente na solução. Para uma solução de um soluto volátil a pressão de vapor da solução resultante é dada por:
psolução = x solvente}  p* solvente + x soluto
p* solvente + x soluto  p* soluto (2)
p* soluto (2)
onde p*soluto é a pressão de vapor do soluto puro e xsoluto é a fracção molar de soluto na solução.
No caso do soluto ser não-volátil, p*soluto << p*solvente, e como xsolvente > xsoluto , a segunda parcela da equação (2) pode ser desprezada, resultando em:
psolução = x solvente  p* solvente (3)
p* solvente (3)
Criada em 2 de Novembro de 2009
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010