A genética e o mar
Referência : Neto, J. L., Duarte, M. R., Silva, E. P., (2019) A genética e o mar, Rev. Ciência Elem., V7(1):015
Autores: Jéssica Lopes Neto, Michelle Rezende Duarte e Edson Pereira da Silva
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2019.015]

A genética marinha é um campo interdisciplinar da biologia que se dedica ao estudo da genética dos organismos marinhos sob uma perspetiva populacional, evolutiva e ecológica, integrando conhecimentos da genética de populações, biologia molecular e biologia marinha.
Entende-se por genética a ciência que estuda os fatores hereditários (ou genes) dos indivíduos e as leis que governam sua transmissão de geração para geração[1]. A constituição genética dos indivíduos pode ser definida como o conjunto de genes (ou genótipos ou alelos) que um indivíduo possui, sendo os genes a unidade funcional da hereditariedade[2]. Quando o interesse é pela mudança na constituição genética dos grupos de indivíduos (as populações) ao longo do tempo, se está estudando genética de populações. Ou seja, a genética de populações estuda como a proporção dos genes muda de uma geração para outra. Mais que isso, ela preocupa-se em entender o que determina que essas mudanças aconteçam. Pode-se dizer, então, que estudá-la é estudar o processo evolutivo[3], [4], [5]. Quando a produção de informações referentes à genética de populações diz respeito a populações naturais de organismos marinhos, entra-se no campo da genética marinha, que pode ser definida como a ciência que estuda a genética de populações de organismos marinhos utilizando-se de uma perspetiva evolutiva (pois trabalha com a mudança) e ecológica (uma vez que também leva em consideração os ambientes em que esses organismos vivem).
Há registros de estudos realizados no campo da genética marinha que datam desde a década de 1910, contudo, em seu início, essa área de conhecimento possuía uma aplicação bastante restrita, visto que enfrentava problemas de ordem prática no que dizia respeito aos tipos de organismos marinhos que podiam ser estudados. Isso se devia em grande parte ao fato de que para se estudar genética de populações era necessário manter as populações estudadas em cultivos laboratoriais de modo que fosse possível a realização de cruzamentos controlados. No caso de espécies marinhas, essa possibilidade era muito limitada. Por exemplo, não era possível estudar organismos de grande porte e, naquele tempo, o cultivo da maioria das espécies marinhas não era viável. Assim, por conta dessas limitações, o desenvolvimento da genética marinha se deu de forma tardia no século XX.
Tal cenário de limitações sofreu uma mudança apenas no final da década de 1960, com a aplicação da técnica de eletroforese de aloenzimas ao estudo da constituição genética dos indivíduos nas populações naturais. As aloenzimas são proteínas que se comportam como diferentes alelos de um mesmo gene e a técnica consiste na separação dessas proteínas por meio da sua migração ao longo de um suporte (que pode ser um gel de amido, agarose ou poliacrilamida ou um papel, como o acetato de celulose) sob a ação de uma corrente elétrica [6], [7]. Depois que essas proteínas são separadas e coradas por processos bioquímicos elas apresentam um padrão de bandas que pode ser interpretado como os genótipos dos indivíduos, como mostrado na FIGURA 1. O fato de que o padrão de bandas de proteínas colorido em um gel pode ser interpretado como alelos advém do chamado “dogma central da biologia molecular” que diz que o DNA é transcrito em RNA e este, por sua vez, traduzido em proteínas (FIGURA 2) [8]. Assim, assume-se que amostrar a variação de aloenzimas é, também, amostrar variação do DNA[9], [10]. Com isso, estava sendo inaugurado o uso daquilo que chamamos de marcadores moleculares, que nada mais são que moléculas que representam genes com algum tipo de variação, de modo que podem ser usados para amostragem da constituição genética das populações naturais. As aloenzimas foram, portanto, o primeiro marcador molecular da história de uma ciência que estava nascendo naquele momento, a genética molecular.
Desde então, as espécies marinhas começaram a ser estudadas rotineiramente com o novo método, visto que não havia mais a necessidade do uso de cultivos laboratoriais e a realização de cruzamentos controlados para se estudar genética marinha. Em muitos casos, apenas uma amostra de tecido dos indivíduos era necessária para o estudo genético das populações desses organismos. Contudo, ainda que a eletroforese de aloenzimas seja usada amplamente, ela apresenta algumas limitações que precisam ser pontuadas. A primeira delas diz respeito a se assumir uma correspondência entre os genes e seus produtos (as proteínas). Ao passo que os aminoácidos são as unidades formadoras das cadeias proteicas, os nucleotídeos são as unidades formadoras dos ácidos nucleicos (DNA e RNA). No código genético, trincas de nucleotídeos, conhecidas como códons, são as responsáveis por codificar os vinte aminoácidos principais que constituem as proteínas. Entretanto, o código genético possui a característica de ser degenerado, o que significa que diferentes códons podem codificar o mesmo aminoácido (FIGURA 2) [11]. Isso quer dizer que algumas mudanças de códons não vão acarretar mudança do aminoácido codificado. Desta forma, pode-se dizer que há casos em que ocorrem mudanças na sequência de nucleotídeos do DNA sem que ocorram mudanças na sequência de aminoácidos da proteína.
A segunda limitação da técnica refere-se à carga elétrica dos aminoácidos. Nessa circunstância, o que se dá é que a substituição de aminoácidos que acontece, ocorre sem mudar a carga, ou seja, os aminoácidos trocados possuem cargas iguais. Assim, como não há mudança na carga elétrica da proteína, também não há mudança da mobilidade dela no gel de eletroforese. Portanto, proteínas com sequências diferentes de aminoácidos vão apresentar um padrão igual de bandas.
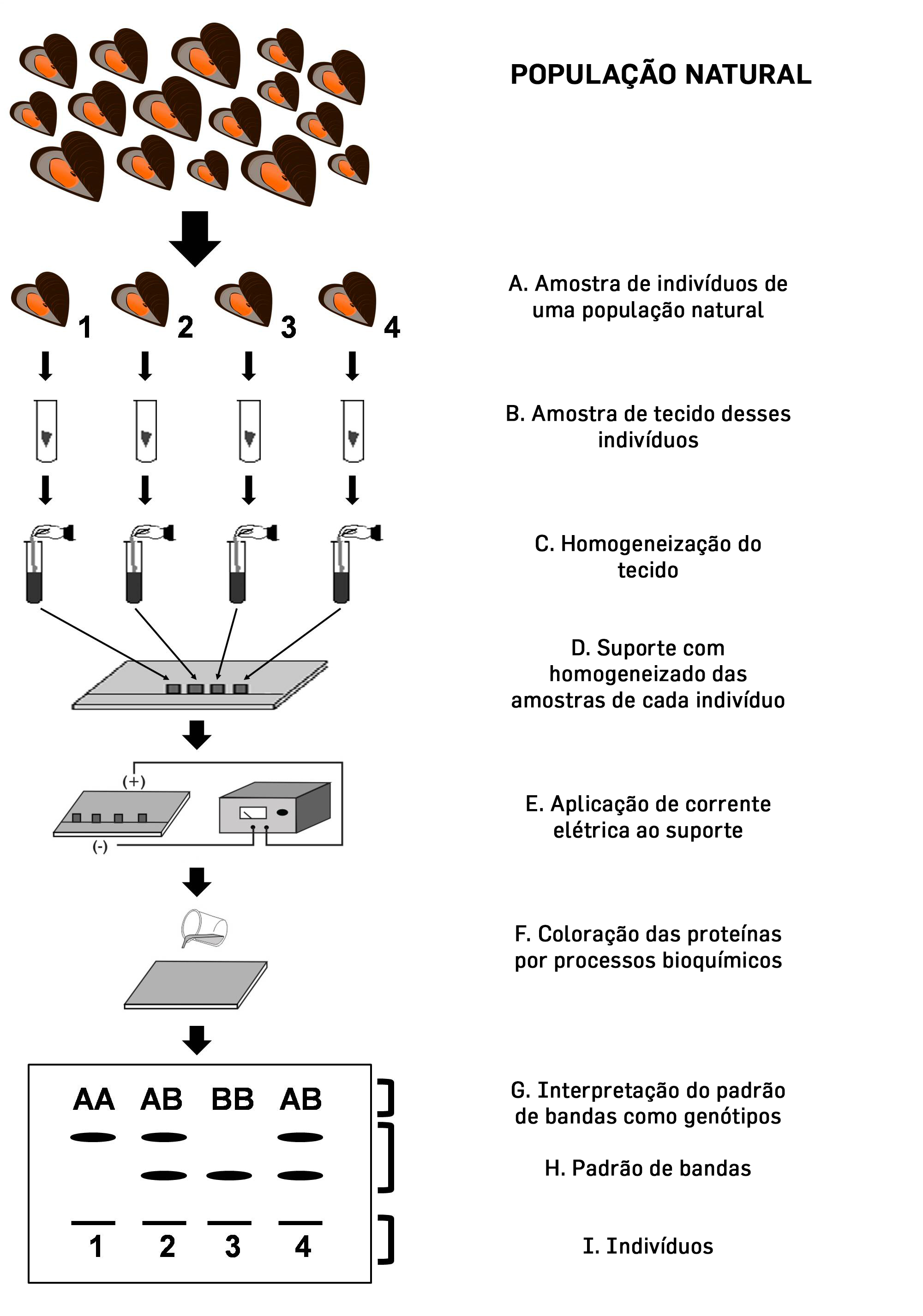
tecido dos indivíduos coletados são retiradas (B) e homogeneizadas (C) antes de serem aplicadas no material
suporte da eletroforese (D). Feito isso, o suporte é submetido a uma corrente elétrica (E) que fará com que
as proteínas migrem ao longo dele de maneira diferenciada em função de seu peso molecular e carga elétrica.
Essas proteínas serão coloridas por processos bioquímicos (F), produzindo um padrão de bandas que pode ser
interpretado como o genótipo dos organismos (G, H, I). Convencionalmente, a banda que percorreu o caminho
mais longo no gel é considerada como o alelo A do gene em questão, e as bandas subsequentes são nomeadas
seguindo a ordem alfabética.
Por fim, uma vez que as proteínas não são diretamente originadas do DNA, mas sim do RNA mensageiro, e que esse sofre um processamento que elimina partes que não codificam nada, os chamados introns, pode-se dizer que a variação presente nessas porções não codificantes do DNA também não é amostrada na eletroforese de aloenzimas. A partir disso, a conclusão a que se chega é de que a técnica é capaz de fornecer apenas uma subestimativa da variação gênica presente no genoma, ou seja, a variação percetível pela técnica de eletroforese é, muito certamente, menor do que aquela que está presente no código genético [12].
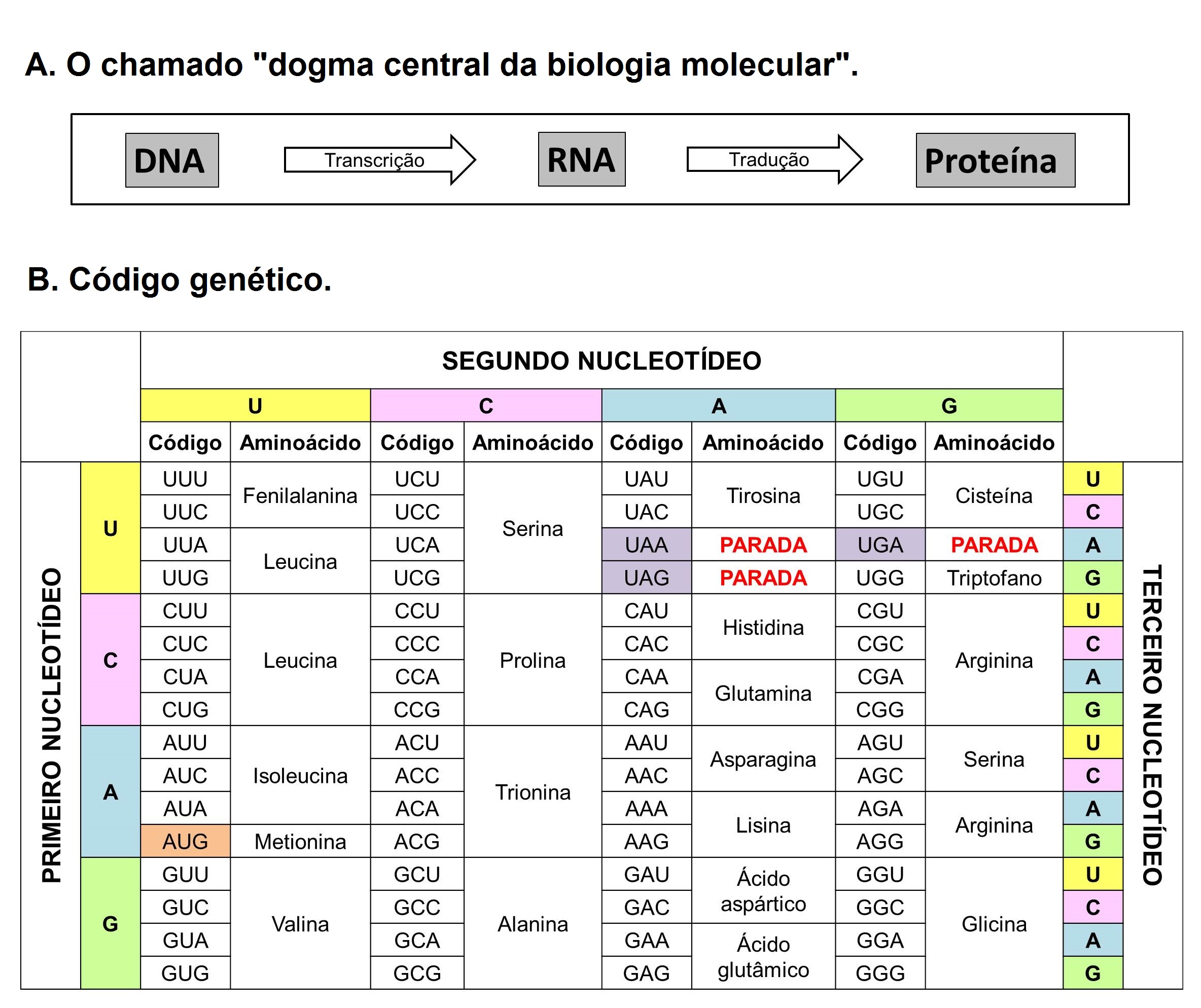
em RNA que é traduzido em proteínas (A) e tabela com as informações referentes à tradução do código genético
em aminoácidos (B). Percebe-se que quase todos os aminoácidos são codificados por mais de uma trinca de
nucleotídeos, com as únicas exceções sendo a metionina e o triptofano.
A partir da década de 1970, muito pelas limitações da eletroforese de aloenzimas, passou-se a usar a recém desenvolvida técnica de sequenciamento de DNA, desenvolvida, em 1975, por Frederick Sanger (1918-2013), o que possibilitou o acesso mais direto à variação gênica presente no código genético [13]. Na década de 1980 surgiu a técnica da Reação em Cadeia da Polimerase (ou PCR, do inglês Polymerase Chain Reaction) desenvolvida, em 1983, por Kary Mullis, o que tornou possível, para um grande número de laboratórios, trabalhar com variação em DNA [14]. A PCR é realizada em uma máquina chamada termociclador, que assim se chama porque repete vários ciclos de temperaturas diferentes que servem para, em última análise, dar origem a uma grande quantidade de cópias de DNA a partir de uma fita dupla original (FIGURA 3). Atualmente, as técnicas que permitem medir a variação gênica têm sofrido uma revolução com os sequenciadores de nova geração ou NGS (New Generation Sequencers, do inglês). Nestas novas tecnologias o sequenciamento de DNA é promovido em plataformas capazes de gerar informação sobre milhões de pares de bases com grande economia de tempo e custo. Apesar das novas técnicas proporcionarem um acesso mais direto à variação presente no código genético do que as aloenzimas, elas ainda representam estimativas indiretas da variação gênica, uma vez que assumem, por exemplo, que o DNA que está sendo amplificado é aquele que se deseja [15], [16].
Explicado tudo isso, os problemas com os quais a genética marinha trabalha encontram-se nos mais diversos campos de conhecimento da biologia marinha, contudo, em última análise, pode-se dizer que todos servem ao mesmo objetivo, que seria a caracterização da biodiversidade presente nos ambientes marinhos. O uso da genética na biologia da pesca, por exemplo, relaciona-se à identificação de unidades reprodutivas (ou estoques) de um determinado recurso pesqueiro. A determinação de estoques pesqueiros é uma tarefa indispensável à conservação do recurso que está sob exploração, uma vez que dependendo do número e tamanho dos estoques as estratégias de conservação utilizadas serão diferentes. Assim, se for demonstrado pela genética marinha, que os indivíduos pertencentes a diferentes regiões pertencem a um mesmo estoque, todos aqueles que exploram tal recurso pesqueiro devem unir seus esforços de manejo de modo a promover a conservação daquela população. Por outro lado, se for observado que cada região possui um estoque diferente, o manejo deve se dar de forma separada, para evitar que os estoques sejam completamente esgotados.
Outro exemplo do uso da genética de populações na biologia marinha é nas áreas de taxonomia e sistemática, que são as ciências responsáveis pela classificação e organização dos seres vivos em grupos hierárquicos. Nesse caso, a genética marinha tem sido amplamente aplicada em estudos de identificação de espécies crípticas, que são aquelas espécies que apresentam características físicas muito semelhantes a ponto de serem confundidas entre si. Tais estudos permitem que essas espécies sejam corretamente classificadas, de modo a fornecer melhores informações a respeito da biodiversidade.
Sem a correta classificação das espécies presentes no ambiente marinho, a conservação e o manejo não podem ser realizados de maneira satisfatória. Variantes de uma mesma espécie que são considerados como pertencentes a espécies diferentes podem gerar esforços inúteis de manejo e conservação que poderiam ser empregados em espécies verdadeiramente distintas. Por outro lado, considerar espécies diferentes como pertencentes a um mesmo grupo nos planos de manejo pode levar à extinção de uma das espécies sem que nem sequer se tenha tido conhecimento sobre ela [17]. A metodologia de DNA barcode (sequenciamento do gene citocromo oxidase I-COI do DNA mitocondrial), tem sido utilizada para caracterizar molecularmente algumas espécies e, dessa forma, tem permitido ações de conservação que dependem de identificação precisa.
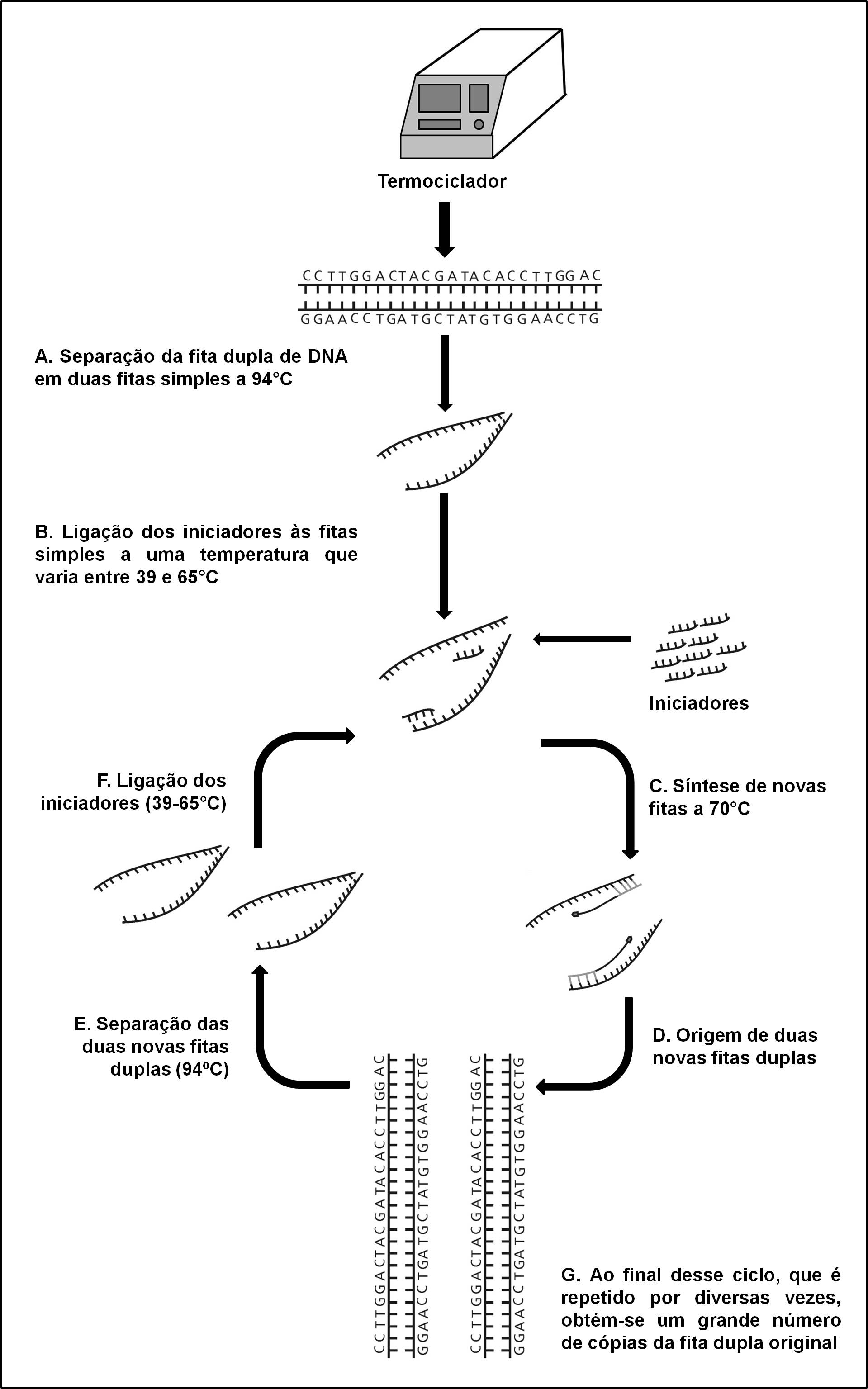
do uso de duas pequenas sequências de nucleotídeos, conhecidas como iniciadores, que são responsáveis por
marcar os limites da porção da fita de DNA que será amplificada. A primeira temperatura utilizada no
termociclador serve para separar a fita dupla da molécula de DNA em duas fitas simples que servirão como
molde para os iniciadores (A). A segunda temperatura é aquela em que esses iniciadores irão se unir às fitas
molde (B). Por fim, na terceira temperatura ocorre a síntese de novas fitas duplas de DNA a partir das fitas
simples nas quais os iniciadores estão acoplados (C). Esse ciclo de temperaturas é repetido por diversas
vezes de modo a produzir uma grande quantidade do DNA molde. Se ao final do primeiro ciclo são originadas
duas fitas duplas a partir da fita dupla original de DNA (D), ao final do segundo ciclo serão produzidas
quatro e assim sucessivamente (E, F, G) em escala exponencial.
A aplicação da genética marinha como ferramenta de estudo da biodiversidade também se dá em estudos sobre bioinvasão. As bioinvasões são a chegada e o estabelecimento de organismos não nativos em ambientes onde eles não ocorrem naturalmente, sendo um fenômeno que na maioria das vezes é mediado pela ação humana. Uma das consequências de uma bioinvasão é a alteração do ecossistema invadido, com possível perda da biodiversidade local e extinção de espécies nativas, o que gera consequências não só ecológicas, mas também sociais e econômicas. Dessa maneira, cada vez mais estudos têm sido realizados com o objetivo de entender como o processo de invasão acontece, e o uso da genética marinha tem se mostrado muito útil em diversos aspetos, como no reconhecimento das espécies invasoras quando elas são ainda muito jovens e não podem ser identificadas por métodos morfológicos; na diferenciação entre essas espécies e as nativas no caso de haver grande semelhança física entre elas; ou mesmo na inferência do local de origem dos organismos invasores. Tudo isso abre maiores possibilidades de controle do processo de bioinvasão [18].
Os exemplos que foram dados representam apenas alguns poucos estudos nos quais a genética marinha tem sido utilizada como ferramenta metodológica, existindo ainda vários outros tipos de problemas que podem ser resolvidos com sua aplicação. Assim, essa ciência ultrapassa as fronteiras disciplinares, integrando conhecimentos de áreas diversas como a genética de populações no que se refere às suas teorias, a biologia molecular com relação às técnicas de que faz uso, e a biologia marinha no que diz respeito aos objetivos que persegue. Dessa forma, pode-se dizer que a genética marinha é uma ciência de caráter interdisciplinar [19].
Referências
- ↑ Lopes, R.P., et al., A Genética e as invasões biológicas: dois estudos de caso de bivalves invasores do Brasil, Genética na Escola, 9(2):86-91, 2014.
- ↑ Moreira, C., Alelo, Rev. Ciência Elem., V3(2):112, 2015.
- ↑ Moreira, C., Evolucionismo, Rev. Ciência Elem., V2(4):318, 2014.
- ↑ Silva, E.P., Genética Marinha. In: Biologia Marinha. 2ed. Pereira, R.C. & Soares-Gomes, A. (eds.). Editora Interciência, Rio de Janeiro, p. 49-69, 2009.
- ↑ Silva, E.P., A short history of evolutionary theory, História, Ciências, Saúde-Manguinhos, 8(3):671-687, 2001.
- ↑ Moreira, C., Alelo, Rev. Ciência Elem., V3(2):112, 2015.
- ↑ Moreira, C., Eletroforese (Biologia), Rev. Ciência Elem., V3(2):104, 2015.
- ↑ Moreira, C., Dogma Central da Biologia, Rev. Ciência Elem., V3(1):055, 2015.
- ↑ Moreira, C., Dogma Central da Biologia, Rev. Ciência Elem., V3(1):055, 2015.
- ↑ Moreira, C., PCR, Rev. Ciência Elem., V2(4):243, 2014.
- ↑ Moreira, C., Código genético, Rev. Ciência Elem., V2(4):251, 2014.
- ↑ Silva, E.P., Genética Marinha. In: Biologia Marinha. 2ed. Pereira, R.C. & Soares-Gomes, A. (eds.). Editora Interciência, Rio de Janeiro, p. 49-69, 2009.
- ↑ Sanger, F. & Coulson, A. R., A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase, J. Mol. Biol., 94: 441-448., 1975.
- ↑ Moreira, C., PCR, Rev. Ciência Elem., V2(4):243, 2014.
- ↑ Silva, E.P., Genética Marinha. In: Biologia Marinha. 2ed. Pereira, R.C. & Soares-Gomes, A. (eds.). Editora Interciência, Rio de Janeiro, p. 49-69, 2009.
- ↑ Solé-Cava, A.M., Biodiversidade molecular e genética da conservação. In: Biologia Molecular e Evolução. Matioli, S.R. & Fernandes, F.M.C. (eds.). Holos Editora, Ribeirão Preto, p. 172-192, 2001.
- ↑ Solé-Cava, A.M., Biodiversidade molecular e genética da conservação. In: Biologia Molecular e Evolução. Matioli, S.R. & Fernandes, F.M.C. (eds.). Holos Editora, Ribeirão Preto, p. 172-192, 2001.
- ↑ Lopes, R.P., et al., A Genética e as invasões biológicas: dois estudos de caso de bivalves invasores do Brasil, Genética na Escola, 9(2):86-91, 2014.
- ↑ Silva, E.P., Genética Marinha. In: Biologia Marinha. 2ed. Pereira, R.C. & Soares-Gomes, A. (eds.). Editora Interciência, Rio de Janeiro, p. 49-69, 2009.
Recursos relacionados disponíveis na Casa das Ciências:
Criada em 25 de Julho de 2018
Revista em 18 de Janeiro de 2019
Aceite pelo editor em 12 de Março de 2019
