A dáfnia como sensor da ecotoxidade
Referência : Ribeiro, O. M., Pinto, M. Q., Ribeiro, C., Tiritan, M. E., Carrola, J. S., (2021) A dáfnia como sensor da ecotoxidade, Rev. Ciência Elem., V9(2):044
Autor: Ondina Martins Ribeiro, Mónica Quelhas Pinto, Cláudia Ribeiro, Maria Elizabeth Tiritan e João Soares Carrola
Editor: José Ferreira Gomes
DOI: [https://doi.org/10.24927/rce2021.044]

Resumo
A libertação de contaminantes para o meio ambiente tem aumentado nas últimas décadas, incluindo os produtos farmacêuticos e seus metabólitos. Podem chegar ao meio ambiente por várias vias e afetar as cadeias tróficas aquáticas e terrestres, mas também a saúde pública. Os efeitos destes compostos associados à exposição aguda e/ou crónica de organismos aquáticos ainda não são bem conhecidos. Desta forma, torna-se importante realizar estudos de ecotoxicologia usando diversos organismos, como peixes ou dáfnias. Os efeitos podem ser avaliados na dáfnia a vários níveis: bioquímica, imobilização, bioacumulação e reprodução. A sensibilização da população e da indústria para gestão adequada do uso e da eliminação dos medicamentos é fundamental para redução da poluição.
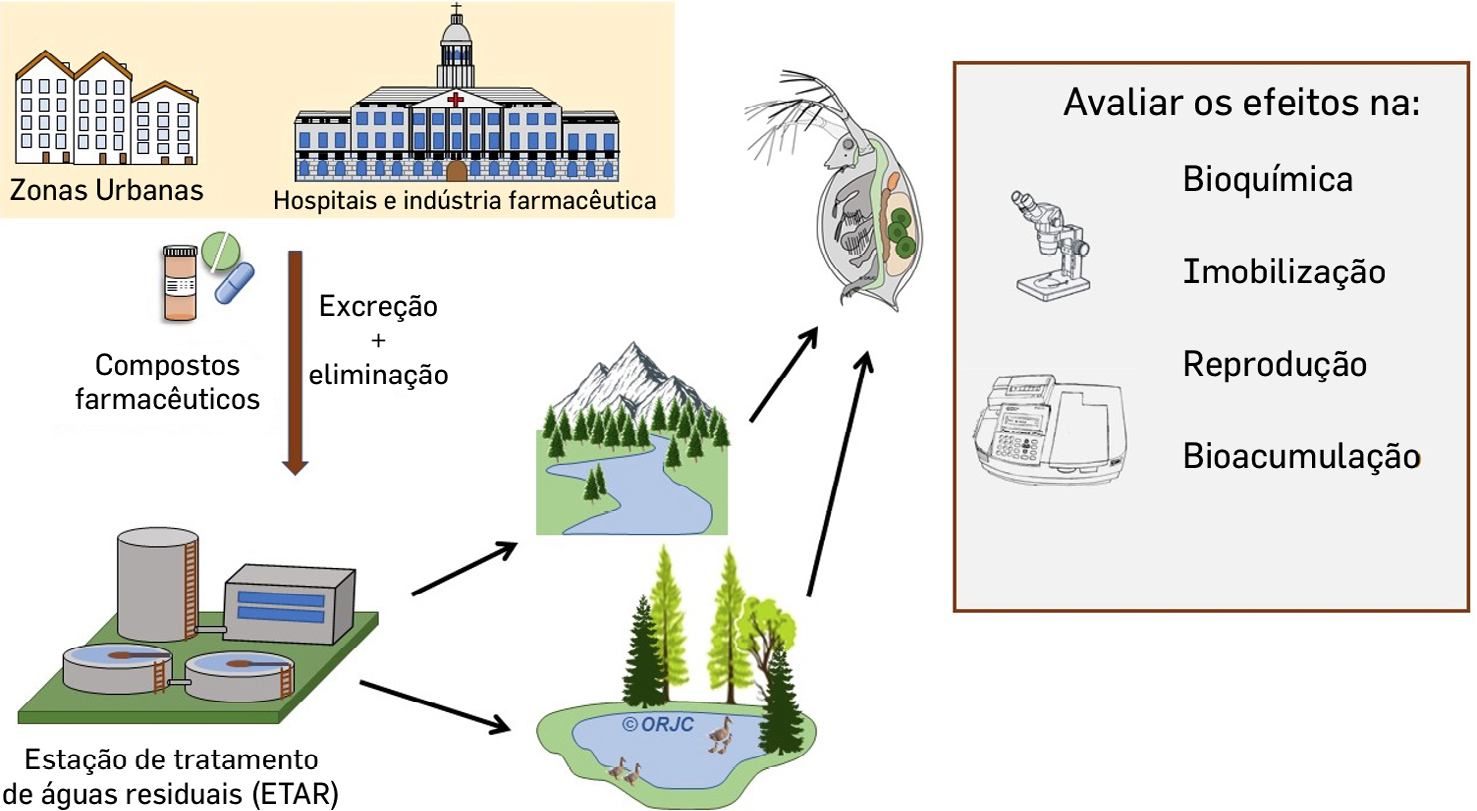
O impacto causado pela entrada de contaminantes emergentes, como os produtos farmacêuticos, nos ecossistemas aquáticos ainda é pouco conhecido devido à reduzida informação relativa à ecotoxicidade, biodegradação e destino dos fármacos[1]. O uso (e abuso) de medicamentos na medicina humana e veterinária contribui cada vez mais para a entrada de fármacos ou dos seus metabolitos nos ecossistemas aquáticos. Estes compostos chegam por várias vias, nomeadamente devido à excreção na urina dos pacientes e animais[2], eliminação voluntária de medicamentos fora de prazo ou não utilizados na sanita[3] (ou lixo) ou ainda a eliminação involuntária pela indústria farmacêutica[4]. Os resíduos de numerosos medicamentos (anti-inflamatórios, beta-bloqueadores, inibidores seletivos da recaptação de serotonina, antifúngicos do grupo dos azóis, antibióticos e outros) chegam posteriormente aos afluentes das estações de tratamento de águas residuais (ETAR). No entanto, mesmo funcionando corretamente estas infra- -estruturas não são completamente eficientes na remoção da maioria dos micropoluentes, incluindo os fármacos. Estes resíduos podem poluir os cursos de água originando misturas complexas de contaminantes que podem provocar efeitos diversos nos organismos aquáticos[5], [6].
Sendo assim, torna-se importante avaliar os efeitos dos produtos farmacêuticos e/o ou seus metabolitos, a curto e médio prazo nos organismos aquáticos, bem como na saúde humana. Numerosos compostos provocam efeitos nos sistemas biológicos, incluindo o sistema endócrino mesmo quando presentes em baixas concentrações, principalmente em situações de exposição crónica[7].
Desta forma, os estudos de ecotoxicologia aquática procuram perceber quais as possíveis respostas reais dos tóxicos ao longo das cadeias tróficas, de maneira a avaliar o impacto da ocorrência dos tóxicos nos vários ecossistemas. Estes dados tornam-se importantes para que as autoridades reguladoras competentes implementem medidas de mitigação adequadas[8], [9], [10].
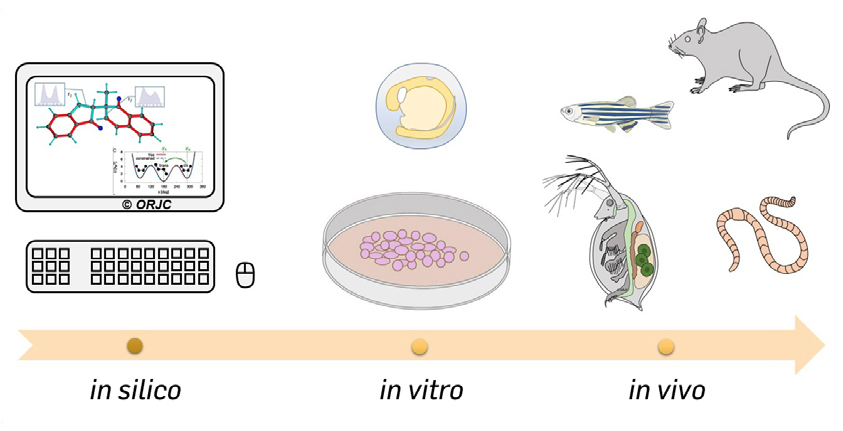
Para a avaliação dos efeitos dos fármacos e seus metabólitos é desejável utilizar várias abordagens, como os testes in silico, in vitro e in vivo (FIGURA 1). Os testes in silico baseiam-se em técnicas computacionais que permitem estimar a toxicidade potencial das moléculas, por comparação, usando bases de dados extensas[11]. Os testes in vitro recorrem a estudos com células, tecidos ou órgãos em condições controladas em laboratório. Os testes in vivo requerem a utilização de organismos vivos que sejam adequados ao tipo de estudo, existindo numerosos testes padronizados que podem ser implementados[12].
A dáfnia tem sido muito usada como organismo modelo na ecotoxicologia[13] devido à sua importância na cadeia alimentar e por ser uma espécie sentinela, bioindicador de perturbações nos ecossistemas aquáticos[14]. Existem também alguns estudos que utilizam dáfnias “contaminadas” para alimentar peixes, e desta forma avaliar as taxas de transferências dos tóxicos nas cadeias alimentares, desde metais pesados até plásticos.
Biologia da dáfnia
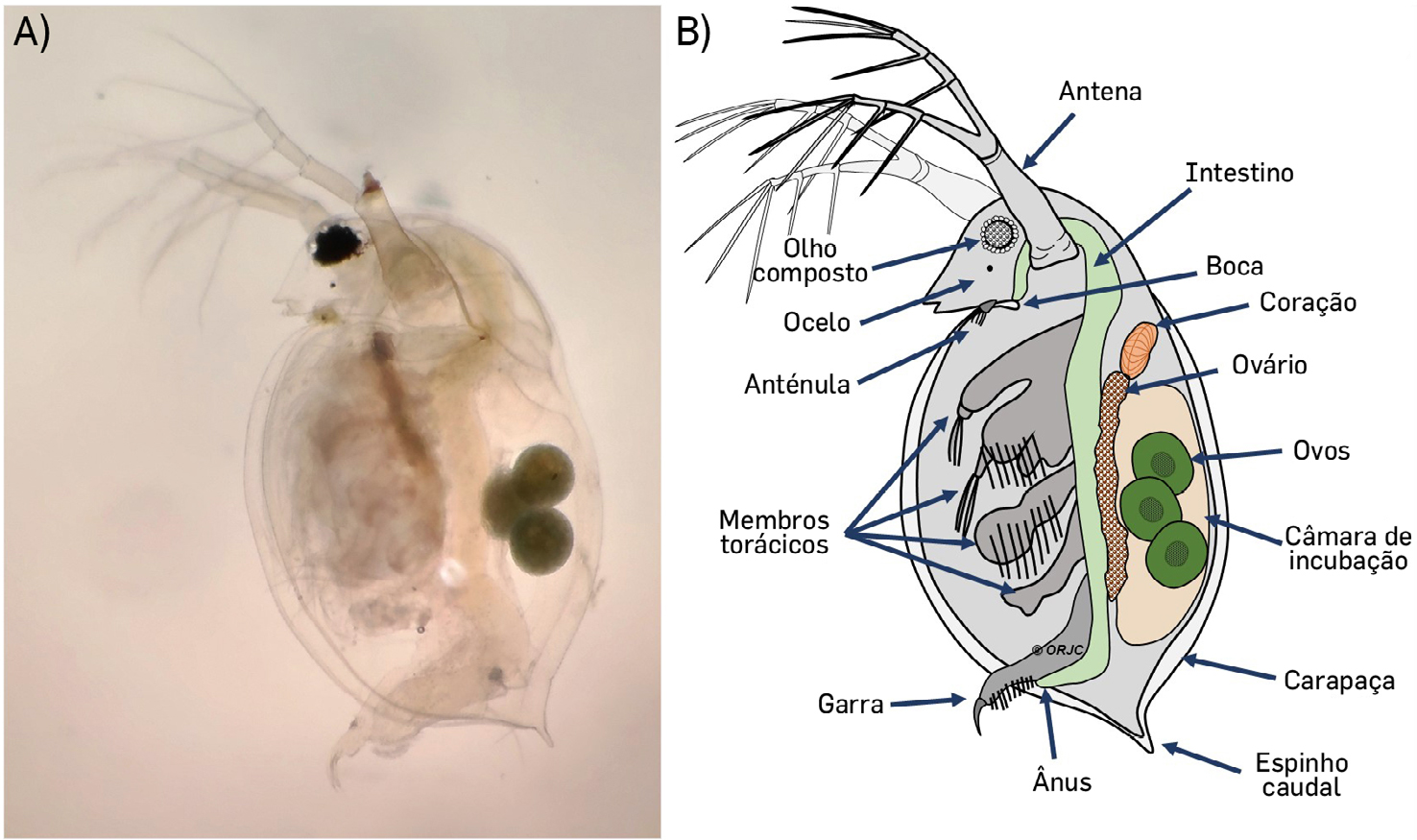
A dáfnia é um microcrustáceo planctónico, com cerca de 5 mm de comprimento, e vive em ecossistemas aquáticos lênticos de água doce preferindo temperaturas entre os 18 e 22 oC[15].
Tem um exoesqueleto transparente composto por quitina, que cobre todo o corpo à exceção da cabeça[16]. Possui dois pares de antenas – as primeiras como órgão sensorial e as segundas como órgão de natação[17], um par de olhos compostos, com a presença de omatídios para a deteção da luz[18] e ainda um pequeno olho simples, chamado ocelo (FIGURA 2).
Também é visível a presença de 4 a 6 pares de membros torácicos, que intervêm juntamente com as antenas na respiração e na alimentação[19]. Na natureza, as dáfnias alimentam-se essencialmente de microalgas, bactérias[20] e detritos orgânicos em suspensão ou depositados no fundo da água[21].
Ciclo de vida e reprodução
Este microcrustáceo pode reproduzir-se tanto sexuada ou como assexuadamente (partenogénese cíclica), dependendo das condições externas - alimentares e ambientais (FIGURA 3).
Sob condições favoráveis as dáfnias reproduzem-se de forma assexuada, levando à produção de ovos diploides, originando filhas geneticamente idênticas (clones). Este tipo de reprodução é importante em estudos ecotoxicológicos para diminuir a variabilidade dos resultados[22].
Sob condições adversas as fêmeas reproduzem-se de forma sexuada, produzindo machos de forma assexuada que vão posteriormente fertilizar os ovos em diapausa internamente[23]. Estes ovos dão origem a ovos haploides fertilizados que não se desenvolvem, ficando num estado de repouso – efípias ou ovos de resistência[24], que são resistentes a condições adversas devido a uma membrana protetora. Quando as condições ambientais se tornam favoráveis à espécie, os ovos de resistência podem eclodir dando origem aos juvenis[25].
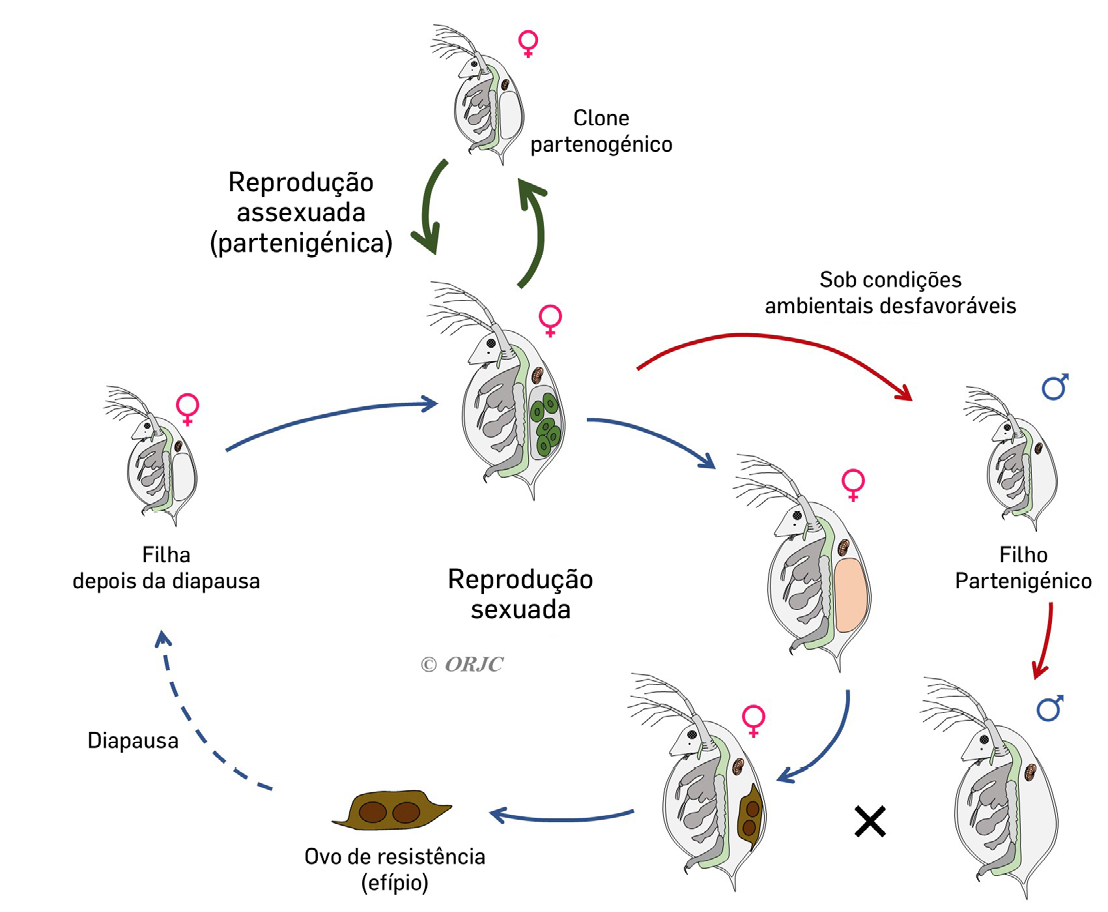
Os juvenis podem sofrer entre 3 a 5 ecdises (libertação do exosqueleto) até à sua maturação, sendo que esta fase é marcada pela primeira postura dos ovos na câmara de incubação[26]. Durante a fase de adolescente ocorre a maturação dos ovos, e posteriormente entram na fase adulta após 10 a 13 dias de vida.
A dáfnia como organismo modeloOs efeitos e os modos de ação de produtos farmacêuticos sob as espécies aquáticas ainda não são totalmente compreendidos, sendo preocupantes uma vez que mesmo em baixas concentrações os compostos podem exercer efeitos prejudiciais nos organismos não-alvo. A dáfnia tem sido muito utilizada como modelo animal em estudos de toxicologia aquática e também noutras outras áreas como a ecologia, devido às suas várias vantagens: elevada sensibilidade a contaminantes, grande relevância ecológica, facilidade de manuseio e manutenção, um ciclo de vida curto, o tipo de reprodução, entre outras[27].
Para avaliar a toxicidade de contaminantes, incluindo os fármacos, existem diversos protocolos padronizados e que foram desenvolvidos por organizações internacionais, nomeadamente a Organização para a Cooperação e Desenvolvimento Económico (OCDE) e a Organização Internacional de Padronização (ISO), de maneira a normalizar os ensaios a realizar em diferentes laboratórios.
No caso da dáfnia, para se poder avaliar os efeitos causados por uma exposição aguda (24 e 48 horas) podemos implementar o teste nº202 da OCDE. Este teste visa estimar a percentagem de imobilização da dáfnia em comparação com os grupos controlo[28]. Para a avaliação dos efeitos causados por uma exposição crónica (21 dias), utiliza-se o teste nº 211 da OCDE, para avaliar os efeitos na reprodução dos animais expostos a determinado químico[29].
Muitos estudos têm sido realizados para avaliar os efeitos de vários tipos de fármacos na imobilização da dáfnia[30], [31] na reprodução[32], [33] no comportamento[34], [35] e até ao nível bioquímico[36].
Apesar da dáfnia não ser um organismo protegido pela legislação relacionada com a ética e bem-estar animal, na realização de ensaios científicos devem ser sempre consideradas as questões de ética. Por exemplo, tentar reduzir o número de animais utilizados sem que coloque em risco a validade do estudo ou no final de um ensaio colocar os animais do grupo controlo de novo no meio de cultura, ou então utilizar estes animais para fins pedagógicos ou de educação ambiental minimizando sempre que possível o número de invertebrados mortos.
A dáfnia desempenha um papel fundamental em termos ecológicos, como elemento da base das redes alimentares e a sua presença/ausência pode dar informações valiosas sobre a perturbação dos ecossistemas aquáticos. Apesar de ser um organismo de reduzida dimensão tem sido muito utilizado como organismo modelo em numerosas diretrizes de organizações internacionais para estudar os efeitos ecotoxicológicos de numerosas substâncias, incluindo os resíduos de fármacos.
Referências
- ↑ KÜSTER, A. & ADLER, N., Pharmaceuticals in the environment: scientific evidence of risks and its regulation, Philosophical Transactions of the Royal Society B: Biological Sciences, 369, 20130587. 2014.
- ↑ DAUGHTON, C. G. & RUHOY, I. S., Environmental footprint of pharmaceuticals: the significance of factors beyond direct excretion to sewers, Environmental toxicology and chemistry, 28, 2495-2521. 2009.
- ↑ KUSTURICA, M. P. et al., Reviews of Environmental Contamination and Toxicology, Volume 240, 71-104, Springer. 2016.
- ↑ COURTIER, A. et al., Human pharmaceuticals: Why and how to reduce their presence in the environment, Current Opinion in Green and Sustainable Chemistry, 15, 77-82, DOI: 10.1016/j.cogsc.2018.11.001. 2019.
- ↑ BRODIN, T. et al., Ecological effects of pharmaceuticals in aquatic systems—impacts through behavioural alterations, Philosophical Transactions of the Royal Society B: Biological Sciences, 369, 20130580. 2014.
- ↑ FLAHERTY, C. M. & DODSON, S. I., Effects of pharmaceuticals on Daphnia survival, growth, and reproduction, Chemosphere, 61, 200-207. 2005.
- ↑ VANDENBERG, L. N. et al., Hormones and endocrine-disrupting chemicals: low-dose effects and nonmonotonic dose responses, Endocrine reviews, 33, 378-455. 2012.
- ↑ YANG, Y., Life cycle freshwater ecotoxicity, human health cancer, and noncancer impacts of corn ethanol and gasoline in the US, Journal of cleaner production, 53, 149-157. 2013.
- ↑ MARZULLO, R. et al., New method to calculate water ecotoxicity footprint of products: A contribution to the decision- -making process toward sustainability, Journal of Cleaner Production 188, 888-899, DOI: 10.1016/j.jclepro.2018.03.307. 2018.
- ↑ ROMANO, S. et al., Ecotoxicity, genotoxicity, and oxidative potential tests of atmospheric PM10 particles, Environment, 117085. 2019.
- ↑ KHAN, P. M. et al., Chemometric modeling of Daphnia magna toxicity of agrochemicals, Chemosphere, 224, 470-479. 2019.
- ↑ HEGER, S. et al. Comparative ecotoxicity of potential biofuels to water flea (Daphnia magna), zebrafish (Danio rerio) and Chinese hamster (Cricetulus griseus) V79 cells, Science of The Total Environment, 631, 216-222. 2018.
- ↑ JANSEN, M. et al., Thermal tolerance in the keystone species Daphnia magna—a candidate gene and an outlier analysis approach, Molecular ecology, 26, 2291-2305. 2017.
- ↑ LE, Q.-A. V. et al., Daphnia in water quality biomonitoring-“omic” approaches, Toxicology and Environmental Health Sciences, 8, 1-6. 2016.
- ↑ VANOVERBEKE, J., Habitat size and the genetic structure of a cyclical parthenogen, Daphnia magna, Heredity, 98, 419. 2007.
- ↑ COVICH, A. P. et al., Ecology and classification of North American freshwater invertebrates, 695-723. 2010.
- ↑ BAILLIEUL, M. & BLUST, R., Analysis of the swimming velocity of cadmium-stressed Daphnia magna, Aquatic Toxicology, 44, 245-254. 1999.
- ↑ EBERT, D., Ecology, epidemiology, and evolution of parasitism in Daphnia, 110. 2005.
- ↑ PEÑALVA-ARANA, D. et al., Studying Daphnia feeding behavior as a black box: a novel electrochemical approach, Hydrobiologia, 594, 153-163. 2007.
- ↑ LAMPERT, W., Daphnia: model herbivore, predator and prey, Polish journal of ecology, 54, 607-620. 2006.
- ↑ SMIRNOV, N. N., Physiology of the Cladocera, Vol. 2, Ch. 4, 39–88. 2017.
- ↑ ANTUNES, S. C. & CASTRO, B. B., Pulgas-de-água (Daphnia spp.), Rev. Ciência Elem., V5(4):050. (2017). DOI: 10.24927/rce2017.050.
- ↑ CAMPOS, B. et al. Differential gene transcription across the life cycle in Daphnia magna using a new all genome custom- made microarray, BMC genomics, 19, 370. 2018.
- ↑ SMIRNOV, N. N., Physiology of the Cladocera, Ch. 11, 151-174. 2017.
- ↑ SLUSARCZYK, M. et al., Dormancy in Aquatic Organisms. Theory, Human Use and Modeling, Vol. 92, 137-161. 2019.
- ↑ JONCZYK, E. & GILRON, G., Small-scale freshwater toxicity investigations, Vol. 1, Ch. 10, 337-393, 2005.
- ↑ MINGUEZ, L. T. et al., Transgenerational effects of two antidepressants (sertraline and venlafaxine) on Daphnia magna life history traits, Environmental science & technology, 49, 1148-1155. 2015.
- ↑ OECD, Test No. 202: Daphnia sp. Acute Immobilisation Test, OECD Guidelines for the Testing of Chemicals, Section 2, OECD Publishing, Paris. 2004.
- ↑ OECD, Test No. 211: Daphnia magna Reproduction Test, OECD Guidelines for the Testing of Chemicals, Section 2, OECD Publishing, Paris. 2012.
- ↑ JURECZKO, M. & PRZYSTAS, W., Ecotoxicity risk of presence of two cytostatic drugs: bleomycin and vincristine and their binary mixture in aquatic environment, Ecotoxicology and environmental safety, 172, 210-215. 2019.
- ↑ DIONÍSIO, R. et al., Multi-parametric analysis of ciprofloxacin toxicity at ecologically relevant levels: Short-and long- -term effects on Daphnia magna, Environmental Toxicology and Pharmacology, 74, 103295. 2020.
- ↑ CASTRO, B. B. et al., Transgenerational effects of toxicants: an extension of the daphnia 21-day chronic assay?, Archives of environmental contamination and toxicology, 74, 616-626. 2018.
- ↑ HEYE, K. et al. Ecotoxicological characterization of the antiepileptic drug carbamazepine using eight aquatic species: baseline study for future higher tier tests, Journal of Environmental Science and Health, Part A, 54, 441-451. 2019.
- ↑ NIELSEN, M. E. & ROSLEV, P., Behavioral responses and starvation survival of Daphnia magna exposed to fluoxetine and propranolol, Chemosphere, 211, 978-985. 2018.
- ↑ PAROLINI, M. et al., Benzoylecgonine exposure induced oxidative stress and altered swimming behavior and reproduction in Daphnia magna, Environmental Pollution, 232, 236-244. 2018.
- ↑ DING, J. et al., Bioconcentration of the antidepressant fluoxetine and its effects on the physiological and biochemical status in Daphnia magna, Ecotoxicology and environmental safety, 142, 102-109. 2017.
Criada em 8 de Setembro de 2020
Revista em 16 de Setembro de 2020
Aceite pelo editor em 15 de Junho de 2021
