Partícula alfa
Referência : Lima, L.S., (2014) Partícula alfa, Rev. Ciência Elem., V2(4):085
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.085]

Uma partícula α (alfa) é constituída por um agregado de dois protões e dois neutrões e resulta do decaimento radioactivo de elementos com núcleos instáveis. Dada a presença de 2 protões e ausência de electrões, as partículas α têm carga total +2. A sua composição é idêntica à do núcleo de hélio (2 protões + 2 neutrões), pelo que é frequentemente designada como tal e representada como 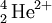 . Tem uma massa de 6,644 656 20(33)
. Tem uma massa de 6,644 656 20(33)  10-27 kg ou 4,001 506 179 127(62) u (unidades de massa atómica).[1] A energia cinética da maioria das partículas α emitidas varia entre 3 e 7 MeV (mega electrões-volt).
10-27 kg ou 4,001 506 179 127(62) u (unidades de massa atómica).[1] A energia cinética da maioria das partículas α emitidas varia entre 3 e 7 MeV (mega electrões-volt).
As partículas α são, normalmente, emitidas pelos elementos radioactivos mais pesados. O elemento mais leve que se conhece ser capaz de decaimento nuclear por emissão de partículas α é o telúrio (Z = 52), mais concretamente os seus isótopos com números de massa 106 e 110. Após a formação e emissão de uma partícula α, o elemento resultante encontra-se, frequentemente, num estado excitado. Esse excesso de energia é libertado sob a forma de radiação ɣ (gama). Como as partículas α têm 2 protões e 2 neutrões, o átomo do elemento que emita uma partícula α vê diminuído o seu número de massa em 4 unidades e o seu número atómico em 2 unidades. Tal facto resulta na formação de um novo elemento. Por exemplo, o isótopo 238 de urânio após um decaimento α, resulta na formação do isótopo 234 de tório, de acordo com a equação nuclear seguinte:
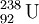 |
 |
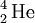 |
+ |
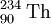 |
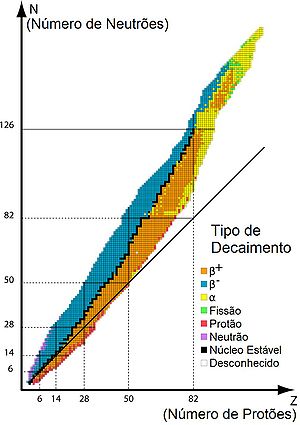
O decaimento radioactivo com formação de partículas α acontece nos elementos onde a razão entre o número de neutrões e o número de protões é inferior à de um núcleo estável (ver figura 1). O decaimento α contribui para o aumento dessa razão. No exemplo indicado, cada átomo de urânio tem 92 p + 146 n (p = protões; n = neutrões), o que dá um quociente de 146/92 = 1,587, e cada átomo de tório resultante tem 90 p + 144 n, o que eleva o quociente n/p para 144/90 = 1,600.
Foi Ernest Rutherford, físico e químico neozelandês que viveu nos séculos XIX e XX, quem, em 1899, designou por α a radiação com menor poder penetrante mas altamente ionizante emitida pelos elementos radioactivos tório e urânio. De facto, uma simples folha de papel ou a superfície da pele humana são suficientes para impedir a progressão de uma partícula α. A descoberta destas partículas, contribuiu para a descoberta da estrutura do átomo por Rutherford, com a colaboração dos seus alunos Hans Geiger (físico alemão) e Ernest Marsden (físico inglês/neo-zelandês). Ao incidir um pequeno feixe de radiação α numa folha de ouro com apenas algumas centenas de átomos de espessura, Rutherford provou a existência do núcleo atómico e que a teoria do “pudim de passas” de Joseph Thomson estava errada.
O decaimento radioactivo por emissão de partículas α é uma fonte segura de energia usada nos geradores termoeléctricos de radioisótopos, utilizados em sondas espaciais e “pacemakers”. Apesar do seu poder altamente ionizante, e, portanto, muito perigoso para os tecidos humanos em caso de contacto directo, as partículas α podem ser facilmente travadas dado o seu baixo poder penetrante. Assim, as partículas α emitidas pelo decaimento radioactivo do plutónio-238, por exemplo, requerem uma barreira de chumbo com apenas 2,5 mm de espessura para serem totalmente absorvidas. Apesar de perigoso, o seu poder ionizante destrutivo pode ter benefícios, pois está a ser desenvolvida e testada uma técnica de radioterapia onde uma pequena quantidade de radiação α é direccionada para um tumor, de forma a destruir o tecido canceroso e prevenir possíveis danos nos tecidos saudáveis à sua volta.[2]
Referências
1. Atomic and nuclear constants, consultado em 10/12/2010
2. W.A. Volkert, T.J. Hoffman, Chem. Rev. 99 (1999) 2269-2292.
Criada em 27 de Dezembro de 2010
Revista em 06 de Fevereiro de 2011
Aceite pelo editor em 08 de Fevereiro de 2011