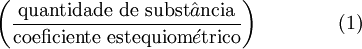Reagente limitante
Referência : Fernandes, R.F., (2015) Reagente limitante, Rev. Ciência Elem., V3(3):184
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.184]
O reagente limitante é o reagente que numa reacção química se encontra em defeito, de acordo com as proporções estabelecidas pela equação química correspondente (proporções estequiométricas). Deste modo, a quantidade máxima possível de produto de reacção é determinada pela quantidade existente de reagente limitante, que é completamente consumido se as reacções químicas forem completas. Os reagentes que no decurso de uma reacção química completa não se gastam na totalidade são designados por reagentes em excesso ou excedentários. Porém, quando os reagentes estão em proporções estequiométricas, todos os reagentes são reagentes limitantes.
Considere-se o exemplo da equação química seguinte que representa a reacção entre o trióxido de diferro (Fe2O3) e o alumínio (Al):
Fe2O3(s) |
+ |
2 Al(s) |
 |
2 Fe(s) |
+ |
Al2O3(s) |
Através da equação verifica-se que uma mole de trióxido de diferro (Fe2O3) reage com duas moles de alumínio (Al), originando duas moles de ferro (Fe) e uma mole de trióxido de dialumínio (Al2O3). Supondo que se colocam 30,0 g de Fe2O3 na presença de 12,0 g de Al em condições propícias à reacção, qual é o reagente limitante?
O primeiro passo consiste em converter a massa dos reagentes em quantidade de substância. Atendendo aos valores de massa molar de cada um dos reagentes tem-se:
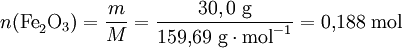
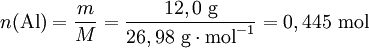
De seguida, para identificar o reagente limitante podem utilizar-se três métodos:
Método 1) Verificar qual dos reagentes se encontra em menor quantidade relativa
O reagente limitante é o que, numa reacção química, se encontra em menor quantidade relativa, ou seja, é aquele que apresenta menor quociente entre a respectiva quantidade de substância e o respectivo coeficiente estequiométrico na equação química que descreve a reacção. Algebricamente, o reagente limitante corresponde ao valor mínimo obtido através da equação (1) para os diferentes reagentes.
Assim, para a reacção acima referida em que a proporção estequiométrica (Fe2O3:Al) é 1:2, virá:
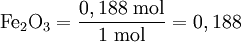
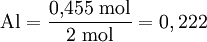
O menor dos dois quocientes é correspondente a Fe2O3 (0,188), logo este é o reagente limitante. Esta forma de identificar o reagente limitante é particularmente útil quando há mais do que dois reagentes.
Método 2) Determinar o reagente que se encontra em defeito
Através das proporções estequiométricas, determina-se qual dos reagentes se encontra em defeito. Deste modo, atendendo a que uma mole de Fe2O3 reage com duas moles de Al, qual o número de moles de Al necessário para reagir com 0,188 moles de Fe2O3?
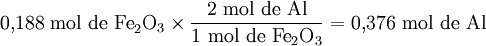
Verifica-se que são necessárias 0,376 moles de Al para reagir com 0,188 mol de Fe2O3.
Assim, uma vez que existem 0,455 mol de Al disponíveis para reagir, ou seja, uma quantidade superior à necessária para reagir com 0,188 mol de Fe2O3, o Al encontra-se em excesso. Logo, Fe2O3 é o reagente limitante.
Método 3) Calcular qual dos reagentes origina uma maior quantidade de produto de reacção
As proporções estequiométricas entre os reagentes e os produtos de reacção estabelecidas pela equação química, permitem calcular a quantidade máxima de produto que teoricamente se pode formar. Assim, o reagente limitante é aquele que, de acordo com a quantidade existente e com a proporção estequiométrica, produz uma menor quantidade de produto. Note-se que para calcular a quantidade de produto de reacção formado a partir dos regentes basta utilizar um dos produtos de reacção obtidos, uma vez que os resultados são independentes quer se opte por um ou por outro. No caso da reacção acima optou-se por calcular a quantidade formada de Fe.
De seguida, de acordo com a relação estequiométrica da equação, calcula-se a quantidade de produto de reacção que é formada a partir da quantidade de substância de cada reagente.
Quantidade de substância de Fe formada a partir de 0,188 mol de Fe2O3:
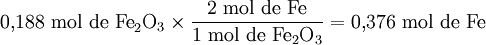
Quantidade de substância de Fe formada a partir de 0,445 mol de Al:
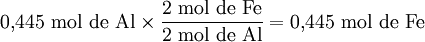
Verifica-se que é o reagente limitante é Fe2O3, uma vez que origina uma menor quantidade de produto de reacção, neste caso Fe.
Referências
General Chemistry Glossary: limiting reactant , consultado em 08/04/2010.
Source Book: Stoichiometry, consultado em 08/04/2010.
UCDavis ChemWiki: Limiting Reagents, consultado em 08/04/2010.
Criada em 10 de Dezembro de 2010
Revista em 14 de Dezembro de 2010
Aceite pelo editor em 14 de Dezembro de 2010