Propriedades intensivas e Propriedades extensivas
Referência : Lima, L.S., (2015) Propriedades intensivas e Propriedades extensivas, Rev. Ciência Elem., V3(4):240
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.240]
As propriedades intensivas são propriedades físicas que não dependem da extensão do sistema, isto é, são independentes do tamanho ou da quantidade de matéria de um dado sistema. Já as propriedades extensivas, tal como o nome indica, dependem da extensão do sistema, isto é, variam de forma proporcional com o tamanho ou a quantidade de matéria existente num dado sistema.
A seguir são apresentados alguns exemplos de propriedades intensivas e extensivas, com os respectivos símbolos e unidades SI entre parênteses:
- Propriedades intensivas: temperatura (T em K), pressão (p em Pa), massa volúmica (
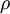 em kg
em kg m-3), ponto de fusão (T em K), ponto de ebulição (T em K).
m-3), ponto de fusão (T em K), ponto de ebulição (T em K).
- Propriedades extensivas: massa (m em kg), volume (V em m3), quantidade de substância (n em mol), energia interna (U em J), entalpia (H em J), entropia (S em J/K), capacidade calorífica (Cp ou CV em J/K), energia de Gibbs (G em J).
Quando se exprime uma propriedade extensiva em função de outra propriedade extensiva, obtém-se uma propriedade intensiva. Por exemplo, quando se exprimem as propriedades termodinâmicas entalpia ou entropia em função da quantidade de substância, obtêm-se as respectivas propriedades intensivas entalpia molar e entropia molar, com unidades SI de J mol-1.
mol-1.
Da mesma forma, se a entalpia ou a entropia, por exemplo, forem expressas em função da massa do sistema, obtêm-se as propriedades intensivas entalpia e entropia específicas com unidades SI de J kg-1. Outros exemplos de propriedades intensivas obtidas por combinação de propriedades extensivas incluem o volume molar (Vm em m3
kg-1. Outros exemplos de propriedades intensivas obtidas por combinação de propriedades extensivas incluem o volume molar (Vm em m3 mol-1), o volume específico (v em m3
mol-1), o volume específico (v em m3 kg-1), a massa molar (M em kg
kg-1), a massa molar (M em kg mol-1) ou a capacidade calorífica específica (cp ou cV em J
mol-1) ou a capacidade calorífica específica (cp ou cV em J K-1
K-1 kg-1) e molar (Cp ou CV em J
kg-1) e molar (Cp ou CV em J K-1
K-1 mol-1).
mol-1).
Criada em 27 de Fevereiro de 2010
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010
