Processo de Ostwald
Referência : Ribeiro, D., (2015) Processo de Ostwald, Rev. Ciência Elem., V3(2):143
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.143]

O processo de Ostwald é o principal processo industrial de obtenção de ácido nítrico e consiste na oxidação do amoníaco com dioxigénio molecular e subsequente hidratação dos óxidos de azoto formados. A importância deste processo resulta das variadas aplicações do ácido nítrico.
Este processo foi patenteado em 1902 pelo químico alemão Wilhelm Ostwald (1853 – 1932) que mais tarde, em 1909, recebeu o Prémio Nobel da Química pelo seu trabalho sobre a catálise nas reações químicas.[1] Ostwald desde estudante revelou-se interessado em diversas temáticas e na autoaprendizagem[2]; foi professor de Química no Instituto Politécnico de Riga e na Universidade de Leipzig, contando-se entre os seus alunos mais famosos Arrhenius (Prémio Nobel em 1903), Van‘t Hoff (Prémio Nobel em 1901) e Nernst (Prémio Nobel em 1920)[3].
No processo de Ostwald,[4] o amoníaco e o dioxigénio são inicialmente aquecidos a cerca de 800 °C para formar monóxido de azoto (reacção catalisada por um catalisador de platina-ródio):
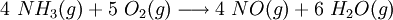
Seguidamente, o monóxido de azoto (antigamente designado “óxido nítrico”) é oxidado a dióxido de azoto, na ausência de qualquer catalisador:
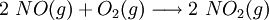
Posteriormente, faz-se passar através da água o dióxido de azoto formado, resultando a formação de ácido nítrico e de ácido nitroso:
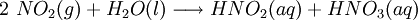
Por aumento de temperatura, o ácido nitroso, produzido anteriormente, também é convertido em ácido nítrico:
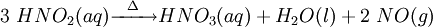
O monóxido de azoto, resultante deste passo final do processo de Ostwald, é reciclado, reintegrando-o no processo, especificamente no segundo passo da cadeia de reações.
O ácido nítrico é um dos ácidos inorgânicos mais importantes e é utilizado na produção de corantes, fertilizantes, explosivos, fármacos e outros. Por reação do ácido nítrico com amoníaco obtém-se nitrato de amónio que tem variadas aplicações como fertilizante, como herbicida, como explosivo, como propelente de foguetes, etc. O ácido nítrico é também bastante utilizado na nitração de compostos orgânicos, originando alguns dos mais conhecidos explosivos, como o trinitrotolueno (vulgarmente designado TNT) e a trinitroglicerina (vulgarmente conhecida por nitroglicerina)[5].
Referências
- A. Stwertka, A guide to the elements, 2nd edition, New York: Oxford University Press, 2002, ISBN: 978-0-19-515026-1.
- F. J. Moore, A History of Chemistry, 1st edition, New York: McGraw-Hill Book Company, Inc., 1918.
- Wilhelm Ostwald - Biography, consultado em 29/03/2012.
- R. Chang, Chemistry, 10th edition, Boston: McGraw-Hill, 2010, ISBN: 978-0-07-351109-2.
- A. Jones, Access to chemistry, Cambridge, UK: Royal Society of Chemistry, 1999, ISBN: 0-85404-564-3.
Criada em 10 de Fevereiro de 2012
Revista em 29 de Março de 2012
Aceite pelo editor em 13 de Abril de 2012
