Ponto de Fusão
Referência : Leal, J.P., (2014) Ponto de Fusão, Rev. Ciência Elem., V2(2):183
Autores: João Paulo Leal
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.183]

Ponto de fusão é a temperatura à qual se dá a passagem do estado sólido ao estado líquido. O ponto de fusão de uma substância depende (embora pouco) da pressão e é usualmente especificado para condições padrão de pressão. Quando se refere a passagem do estado líquido para o estado sólido utilizam-se as designações de ponto de congelação ou de cristalização.[1]
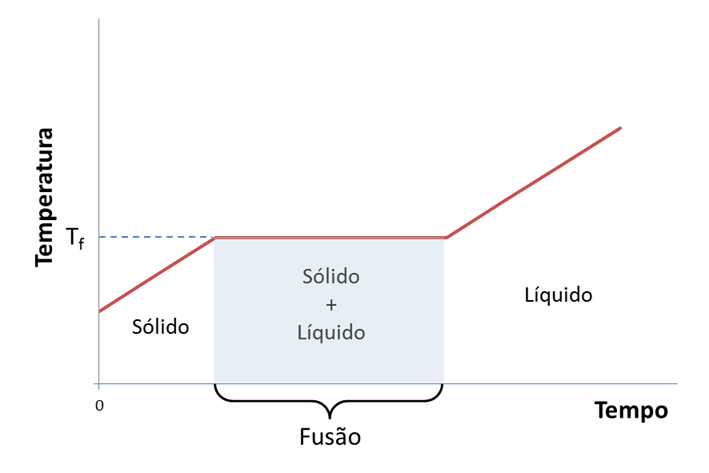
Para sólidos puros, durante o processo de fusão a temperatura do sistema sólido-líquido mantém-se constante (Figura 1). O caso mais conhecido é o do gelo (água sólida) em que a temperatura se mantém a 0 °C durante todo o processo de fusão à pressão padrão de 1 bar (105 Pa), independentemente de existir muito ou pouco gelo em equilíbrio com a água líquida.
Na tabela 1 apresentam-se os pontos de ebulição de algumas substâncias.
| Substância | Fórmula | Tf/K | Tf/ºC |
|---|---|---|---|
| Etanol | C2H5OH | 161,2 | -112,0 |
| Água | H2O | 273,1 | 0,0 |
| Benzeno | C6H6 | 278,6 | 5,5 |
| Fenol | C6H5OH | 313,8 | 40,6 |
| Naftaleno | C10H8 | 353,4 | 80,2 |
| Sódio | Na | 370,8 | 97,7 |
| Chumbo | Pb | 600,1 | 327,0 |
| Ferro | Fe | 1808,1 | 1535,0 |
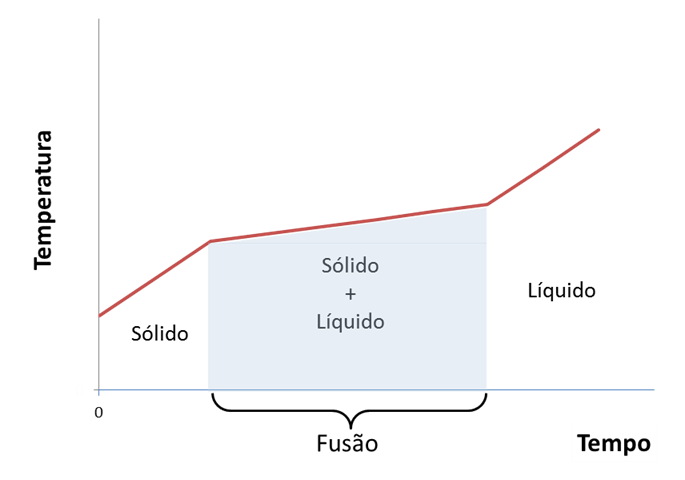
Ao contrário que se verifica para substâncias puras, na grande maioria das misturas as temperaturas de fusão não se mantêm constantes ao longo da transformação (Figura 2). Verifica-se, também, que nestes casos existe separação dos componentes da mistura durante a mudança de fase. Para as misturas, as mudanças de estado físico ocorrem em intervalos de temperatura.[2]
Para misturas sólidas conhecidas como misturas eutéticas, misturas de duas ou mais substâncias em proporções tais que a mistura se comporta como uma substância pura, isto é, a temperatura de fusão é, constante durante todo o processo e não existe separação dos componentes da mistura. Como exemplo de uma mistura eutética podemos referir a solda utilizada para soldar componentes em circuitos electrónicos (mistura de chumbo e estanho na proporção aproximada de 60/40%).
Existem ainda substâncias que têm a capacidade de sobrearrefecer, i.e. manterem-se líquidas abaixo do seu ponto de congelação. Este estado que é termodinamicamente instável (metaestável) evoluirá, mais depressa ou mais devagar, dependendo de condições externas, para o estado mais estável.
Referências
- A. Pires de Matos, I. Santos, J. P.Leal, J. Marçalo, N. Marques, R. T. Henriques, Química: Princípios e Aplicações, Ed. Fundação Calouste Gulbenkian, Lisboa, (2ª ed.), 2010; p.515-516.
- M. E. Arieiro, C. Corrêa, F. P. Basto e N. Almeida, Preparação para o Exame Nacional Física e Química A, Porto: Porto Editora, 2012; ISBN 978-972-0-01669-0
Criada em 08 de Junho de 2012
Revista em 15 de Junho de 2012
Aceite pelo editor em 15 de Junho de 2012