Metal
Referência : Fernandes, R.F., (2015) Metal, Rev. Ciência Elem., V3(2):144
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.144]

Um metal é um elemento que tem capacidade de conduzir a electricidade e o calor, é maleável, dúctil e apresenta, geralmente, um aspecto brilhante (lustroso).
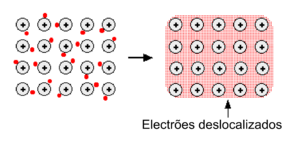
Os metais tendem a ter elevadas temperaturas de fusão e de ebulição, o que indica que os átomos que os compõem estão fortemente ligados entre si. Num metal, os átomos encontram-se ionizados (catiões), ocupando posições bem definidas na estrutura cristalina. Os electrões de valência deslocam-se facilmente ao longo dessa estrutura, formando uma nuvem de electrões deslocalizados (figura 1). Deste modo, as ligações entre os átomos de um metal - ligações metálicas - são efectuadas através da atracção electrostática entre os iões positivos do metal e os electrões que se movem à sua volta. Esta deslocalização dos electrões permite que os metais tenham uma boa capacidade de conduzir electricidade e calor.
A história humana é marcada por diferentes eras de diversos metais (e.g. era do cobre, do estanho, do ferro), nas quais as descobertas dos novos elementos modificaram os paradigmas tecnológicos e sociais de cada época. O ouro foi dos primeiros metais a ser descoberto e rapidamente começou a ser usado como moeda de troca. No Médio Oriente, por volta de 6000 A. C., o cobre era extraído por aquecimento de uma mistura de carvão com minérios, tendo sido utilizado para fazer os primeiros instrumentos metálicos (copos, láminas, etc.).
Os metais e a sua reactividade foram intensamente estudados pelos alquimistas que acreditavam na transmutação, ou seja, a conversão de metais, como o estanho ou chumbo em metais nobres, como o ouro. Dalton acabou formalmente com a alquimia uma vez que propôs que as mudanças ocorridas na matéria resultavam do rearranjo de átomos já existentes. Assim sendo, os átomos de um elemento não podiam transformar-se nos átomos de outro elemento.
Os metais, desde a sua descoberta, começaram a ser misturados com outros elementos para conferir aos metais novas características, criando-se as ligas metálicas, como por exemplo, o bronze (mistura de cobre e estanho), ou o latão (mistura de cobre e zinco).
Na tabela periódica os metais encontram-se na parte esquerda e central, correspondendo a cerca de 80 % dos elementos. Encontram-se separados dos não-metais, que se encontram na parte superior direita, por um conjunto em diagonal de elementos denominados semi-metais, que vai desde o boro até ao polónio. Dentro da tabela periódica, os metais estão agrupados em alcalinos, alcalino-terrosos, de transição, lantanídeos e actinídeos, etc.
Geralmente, os metais reagem com os não metais, como por exemplo o oxigénio e o enxofre, formando óxidos e sulfuretos. Os metais alcalinos são muito reactivos e reagem violentamente com a água. No entanto, os metais nobres, como a prata, o ouro e a platina, são muito pouco reactivos e praticamente não são minimamente atacados.
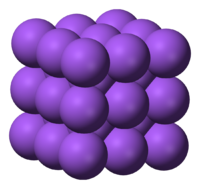
O empacotamento dos átomos metálicos em estruturas compactas (figura 2) leva a que apresentem densidades elevadas e que se encontrem quase todos no estado sólido à temperatura ambiente, à excepção do gálio, mercúrio, césio e frâncio que se encontram no estado líquido.
Os metais apresentam variadas aplicações no quotidiano, de acordo com as particularidades de cada metal:
- Metais com baixas entalpias de vaporização, como o sódio e o mercúrio, são utilizados em lâmpadas de descarga eléctrica, como as lâmpadas fluorescentes e lâmpadas de iluminação pública.
- O tungsténio, que apresenta temperatura de fusão e entalpia de vaporização elevadas, é utilizado em filamentos de lâmpadas incandescentes.
- Dada a baixa reactividade de alguns metais, estes são utilizados em processos de electrodeposição, de modo a evitar a corrosão do metal revestido.
- Alguns metais também são usados para o armazenamento de hidrogénio, actuando como se fossem esponjas formando hidretos pela incorporação de átomos de hidrogénio nas cavidades da estrutura cristalina do metal.
Referências
General Chemistry Glossary, consultado em 15/01/2010.
Chemguide: Metallic Bonding, consultado em 15/01/2010.
Criada em 13 de Março de 2010
Revista em 03 de Fevereiro de 2011
Aceite pelo editor em 03 de Fevereiro de 2011