Ligação metálica
Referência : Fernandes, R.F., (2015) Ligação metálica, Rev. Ciência Elem., V3(2):139
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.139]

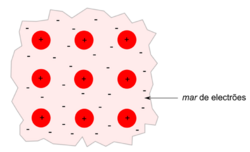
A ligação metálica é uma ligação química que ocorre em metais e ligas metálicas. Considera-se que os átomos da estrutura cristalina do metal se encontram num estado ionizado (catiões) e que os electrões de valência (frequentemente também designados por electrões livres) se encontram deslocalizados, formando aquilo que se designa por mar de electrões. A ligação metálica resulta assim através das interacções electrostáticas atractivas entre os iões positivos e os electrões deslocalizado (figura 1).
A ideia da formação do mar de electrões foi proposta, em 1900, pelo físico alemão Paul Drude. Neste modelo, os electrões de valência apresentam uma elevada mobilidade, não se encontrando ligados a nenhum átomo em particular. A formação do mar de electrões é explicada pela baixa energia de ionização e baixa electronegatividade dos metais que facilmente podem formar iões Mn+. Deste modo, os electrões de valência destes elementos facilmente se podem deslocalizar, criando assim um conjunto de electrões livres. Porém, esta teoria é uma modelo simplificado que apenas descreve qualitativamente como as ligações ocorrem nos metais, não permitindo explicar de uma forma quantitativa as diferenças nas propriedades dos diversos metais. Posteriormente, com o advento da mecânica quântica, o físico suíço Felix Bloch publicou, em 1928, um trabalho que deu origem à teoria das bandas, que permite a racionalização e previsão das propriedades térmicas, eléctricas e magnéticas dos metais.
Os metais apresentam diferentes forças de ligação, que são traduzidas pelas temperaturas de fusão e ebulição. Verifica-se que os elementos metálicos que têm maior número de electrões de valência, um menor tamanho e maior carga nuclear (número atómico) apresentam temperaturas de fusão e ebulição mais elevadas, indicando assim que nestes elementos as ligações são mais fortes.
As ligações metálicas são responsáveis pelas propriedades características dos metais. A condutibilidade eléctrica e térmica é facilmente explicada pela elevada mobilidade dos electrões deslocalizados que se encontram no mar de electrões.
A maleabilidade e ductilidade dos metais são explicadas pelo carácter não direccional das ligações entre os iões positivos e o mar de electrões. Assim, quando se aplica uma força externa à estrutura cristalina de um metal estes electrões deslocalizados ajustam-se imediatamente à deformação que ocorreu, o que evita a sua fractura.
O aspecto lustroso e brilhante dos metais está relacionado com os electrões livres do mar de electrões. A interacção da radiação electromagnética (luz) com os electrões de valência deslocalizados que se encontram à superfície do respectivo mar de electrões induz uma oscilação com a mesma frequência da radiação incidente. Esta oscilação leva a que o metal reflicta a luz à mesma frequência que o atinge, produzindo assim uma aparência brilhante.
A manipulação das ligações entre os átomos dos metais tem aplicações tecnológicas importantes. Os metais no estado puro apresentam geralmente pouca dureza, porém, quando se adiciona outro composto ao metal, criando uma liga metálica, as ligações entre os átomos tornam-se mais fortes dando origem a materiais mais resistentes. Por exemplo, a adição de carbono ao ferro produz uma liga designada por aço, que apresenta ligações metálicas muito mais fortes que o ferro no estado puro. O ouro é um metal que no estado puro (24 quilates; 99,9%) é muito macio, mas quando se encontra num estado menos puro (18 quilates; 75%) apresenta uma maior rigidez.
Referências
http://chemwiki.ucdavis.edu/Theoretical_Chemistry/Chemical_Bonding/Metalic_Bonding, consultado em 26/03/2010.
http://www.chem1.com/acad/webtext/chembond/cb10.html, consultado em 26/03/2010.
http://www.chemguide.co.uk/atoms/bonding/metallic.html#top, consultado em 26/03/2010.
Criada em 08 de Abril de 2010
Revista em 25 de Outubro de 2010
Aceite pelo editor em 25 de Outubro de 2010