Enzima
Referência : Moreira, C., (2015) Enzima, Rev. Ciência Elem., V3(3):162
Autor: Catarina Moreira
Editor: José Feijó
DOI: [http://doi.org/10.24927/rce2015.162]
As enzimas são um grupo de substâncias orgânicas, quase sempre proteínas, que catalizam as reacções, ou seja, facilitam o processo ao baixar a energia de activação necessária, sem nela participarem – são catalisadores.
São fundamentais na homeostase dos organismos, dado que sem a sua presença muitas reacções bioquímicas não ocorreriam. São a base química de toda a vida conhecida.
Nas reacções enzimáticas, as moléculas iniciais ou substratos são convertidas pela acção enzimática em moléculas diferentes, os produtos. A actividade enzimática pode ser afectada por outras moléculas inibidoras ou activadoras da sua actividade. A temperatura também é um factor importante, dado que diferentes enzimas têm intervalos óptimos de temperatura para uma mais eficiente actividade. O pH e a concentração do substrato também afectam a actividade enzimática.
As enzimas têm um intervalo de pH e temperatura óptimos durante o qual a sua actividade é máxima. Abaixo e acima dos valores óptimos de pH a actividade enzimática decresce. O efeito da temperatura na actividade enzimática é diferente. À medida que a temperatura sobe a taxa de actividade da enzima aumenta até atingir o seu máximo, e simultaneamente há uma progressiva inactivação por desnaturação da proteína que se acentua quando a temperatura está acima do óptimo.
As enzimas são especificas para determinados substratos, ou seja, existe uma relação de complementaridade entre a enzima e o respectivo substrato. Algumas enzimas ligam-se apenas a um tipo de substrato catalisando uma única reacção – especificidade absoluta. Outras enzimas ligam-se a diferentes substratos quimicamente semelhantes, catalisando consequentemente várias reacções – especificidade relativa.
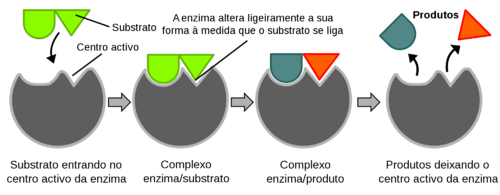
As enzimas possuem um local – centro activo – onde se liga o substrato da reacção. As ligações químicas entre enzima e substrato são, geralmente, muito fracas e não covalentes, para serem reversíveis. Quando enzima e substrato se ligam formam o complexo enzima-substrato. A ligação enzima-substrato é do tipo chave-fechadura (proposto por Emil Fischer em 1894), isto é, quer a enzima quer o substrato têm formas estruturais complementares, fazendo com que se encaixem os pares específicos. Mais tarde em 1958, Daniel Koshland propôs o que ficou conhecido por modelo chave-fechadura induzido, defendendo que os centros activos das enzimas são estruturas flexíveis que alteram a sua forma através da interacção com o substrato (Fig.1).
Figura 1. Esquema da actividade enzimática
Algumas enzimas requerem uma associação a moléculas não proteicas para a sua actividade – os co-factores. O complexo enzima-cofactor activo cataliticamente denomina-se holoenzima. Se o co-factor for removido, a proteína inactiva denomina-se por apoenzima. A maioria dos cofactores são iões inorgânicos, co-enzimas ou grupos prostéticos.
- Iões metálicos inorgânicos – podem ser parte integrante da estrutura da proteína ou podem estar associados com o substrato, facilitando a ligação e a actividade catalítica. Por exemplo, ião Fe2+ associado ao grupo heme da peroxidase e da catalase encontra-se ligado à própria proteína (enzima).
- Coenzimas – são substâncias orgânicas com peso molecular relativamente baixo quando comparado com o das enzimas. Muitas coenzimas possuem um molécula de vitamina na sua estrutura. As coenzimas funcionam como um tipo de substrato para as enzimas ligando-se a elas. Têm funções específicas como a transferência de hidrogénio (o NAD+ em reacções de desidrogenase, por exemplo, na respiração e fermentação) ou de grupos acil (a coenzima A no metabolismo dos ácidos gordos).
- Grupo prostético - quando a coenzima está fortemente ligada à enzima e não há uma quebra dessa ligação após o ciclo catalítico.
As enzimas podem ser alteradas por outras moléculas – enzimas alostéricas – possuindo para além do centro activo um outro centro específico para essas substâncias se ligarem – o centro alostérico. Estas moléculas permitem à célula controlar a actividade enzimática, alterando a conformação da enzima sem que a afinidade ao substrato diminua – inibição alostérica. Em vias metabólicas este tipo de regulação é muito comum. O produto final da via metabólica pode ser actuar como inibidor alostérico de uma enzima presente na cadeia de reacções, a inactivação da enzima inibe a formação de determinado produto por retroalimentação negativa (ou feedback negativo).
Algumas destas substâncias que reduzem a actividade enzimática – os inibidores – actuam directa ou indirectamente influenciando as propriedades catalíticas do centro activo. Os inibidores podem ser reversíveis, quando reagem com a enzima estabelecendo um equilíbrio entre as formas ligadas e não-ligadas – inibição reversível.
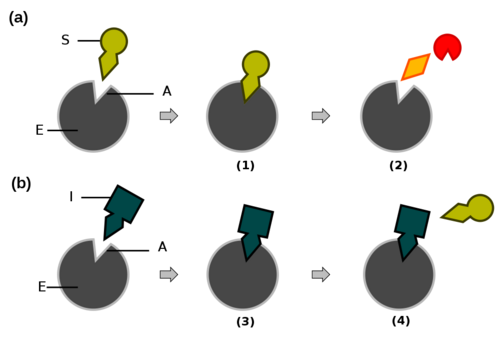
Alguns inibidores podem-se ligar ao centro activo competindo com o substrato – inibição competitiva (Fig.2). Para isso o inibidor tem de possuir uma estrutura química semelhante à do substrato. Por exemplo, a glucose oxidase cujo substrato normal é a D-glucose pode ser inibida pela molécula de D-arabinose, uma pentose tal como a glucose com um estrutura semelhante.
Figura 2. Inibição Enzimática Competitiva.
a) reacção enzimática normal do complexo enzima-substrato b) inibição enzimática A. Centro activo S. substrato E. enzima I. Inibidor (1). Substrato liga-se à enzima (2). Enzima liberta produtos da reacção (3). Inibidor liga-se à enzima (4). Inibidor compete com o substrato
Palavras chave: centro activo, substrato, centro alostérico, inibição competitiva, holoenzima, apoenzima, complexo enzima-substrato, temperatura, pH, inactivação, desnaturação, inibidor, inibição alostérica, inibição competitiva, cofactor, coenzima, especificidade absoluta, especificidade relativa, catalisador
Criada em 20 de Outubro de 2009
Revista em 12 de Julho de 2011
Aceite pelo editor em 08 de Fevereiro de 2012