Aquaporinas
Referência : Ferreira, S., (2014) Aquaporinas, Rev. Ciência Elem., V2(2):031
Autores: Sílvia Ferreira
Editor: Jorge Canhoto
DOI: [http://doi.org/10.24927/rce2014.031]

As aquaporinas são proteínas de canal de água que aumentam a permeabilidade da bicamada lipídica da membrana celular à água. Apesar do movimento da água através da membrana celular ocorrer diretamente através da bicamada lipídica (difusão simples), em certas células a maior parte da osmose é facilitada por estas proteínas integradas, as aquaporinas (difusão facilitada).[1] Estas proteínas contêm um simples poro, seletivo para a água, que permite a rápida passagem desta molécula pela membrana por difusão facilitada.[2] Cada aquaporina permite a entrada de 3x109 moléculas de água por segundo. Sem estas proteínas, apenas uma pequena fração dessas moléculas de água se difundiria através da mesma área da membrana celular em um segundo.[3]
Em 2003, Peter Agre foi laureado com o prémio Nobel da Química pela descoberta dos canais de água. A descoberta das aquaporinas ocorreu por puro acaso, em 1988, quando investigava os antigénios dos grupos sanguíneos Rh. O cientista e a sua equipa descobriram que as aquaporinas eram muito abundantes nos glóbulos vermelhos humanos, com cerca de 200000 cópias por célula. Posteriormente, constataram que estas proteínas integradas também eram muito abundantes nas células dos rins humanos. No entanto, nessa altura ainda não compreendiam a sua função e eram denominadas por proteínas CHIP28.[2]
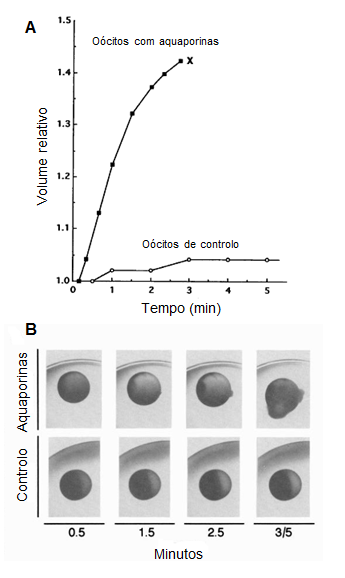
Perante as sugestões de outros cientistas e evidências de alguns estudos, Peter Agre e colaboradores começaram a suspeitar que a proteína CHIP28 era responsável pelo transporte de água e, em 1992, desenvolveram a investigação nesse sentido. Para tal, recorreram a oócitos de rã Xenopus laevis, dado que estes oócitos normalmente têm uma baixa permeabilidade à água. Os oócitos do grupo de controlo foram injetados apenas com água e os oócitos do grupo testado foram injetados com RNA responsável pela codificação da proteína CHIP28. Quando os oócitos foram colocados em água destilada, as diferenças entre os dois grupos ocorreram muito rapidamente. Enquanto os oócitos do grupo de controlo pouco aumentaram de volume, os oócitos do grupo testado tornaram-se muito permeáveis à água e sofreram lise celular – Figura 1, A e B. Estes resultados mostraram que a proteína CHIP28 era um canal de água. [2,4] A proteína CHIP28 passou a denominar-se aquaporina (das palavras em latim, aqua que significa água e porus que significa poro).[5,6]
As aquaporinas têm sido descobertas em organismos dos vários reinos da vida, incluindo organismos unicelulares, como bactérias, leveduras e protozoários, e organismos multicelulares, como plantas e animais.[6] Nas plantas, por exemplo, as aquaporinas mais abundantes encontram-se na membrana plasmática e na membrana do vacúolo (tonoplasto).[7]
Apesar de não se encontrarem em todas as células e em todos os seres vivos, as aquaporinas desempenham um importante papel e estão presentes nas membranas onde é necessária uma passagem rápida das moléculas de água de modo a que essas células possam desempenhar as suas funções.[6,7] Para além de transportarem água, algumas destas proteínas podem transportar glicerol, contribuindo, por exemplo, para o metabolismo dos lípidos nos mamíferos. Outros estudos também sugerem que podem transportar outras pequenas moléculas e gases, como aminoácidos e dióxido de carbono.[7,8] As aquaporinas desempenham, assim, funções em diversos processos biológicos, como as relações de simbiose nos nódulos das leguminosas e nas micorrizas, nas plantas, e a hidratação da pele, nos mamíferos.[7,8]
Figura 1 – Permeabilidade da membrana celular à água em oócitos de Xenopus laevis. (A) A lise celular dos oócitos injetados com RNA que codifica a proteína CHIP28 (aquaporina) está representada por (X). (B) Fotografias dos oócitos no tempo indicado. (Adaptado de Preston et al., 1992, Fig. 2, p.386)
Referências
[1] Agre, P., Preston, G. M., Smith, B. L., Jung, J. S., Raina, S., Moon, C., Guggino, W. B., & Nielson, S. (1993). Aquaporin CHIP: The archetypal molecular channel. American Journal of Physiology - Renal Physiology, 265, 463-476.
[2] Agre, P. (2004). Aquaporin water channels. Bioscience Reports, 24(3), 127-163.
[3] Campbell, N., & Reece, J. (2008). Biology (8ª ed.). San Francisco: Pearson/ Benjamin Cummings.
[4] Preston, G. M., Carroll, T. P., Guggino, W. B., & Agre, P. (1992). Appearance of water channels in Xenopus oocytes expressing red cell CHIP 28 protein. Science, 256, 385–387.
[5] Agre, P., Sasaki, S., & Chrispeels, J. (1993) Aquaporins: a family of water channel proteins. American Journal of Physiology - Renal Physiolog. 265, 461.
[6] Benga, G. (2009). Water channel proteins (later called aquaporins) and relatives: Past, present, and future. Life, 61(2), 112-133.
[7] Maurel, C., Verdoucq, L., Luu, D.-T., & Santoni, V. (2008) Plant aquaporins: Membran channels with multiple integrated functions. Annual Review of Plant Biology, 59, 595-624.
[8] Verkman, A. S. (2011). Aquaporins at a glance. Journal of Cell Science, 124, 2107-2112.
Criada em 30 de Abril de 2013
Revista em 23 de Abril de 2014
Aceite pelo editor em 23 de Abril de 2014