Lei de Boyle
Referência : Lima, L.S., (2014) Lei de Boyle, Rev. Ciência Elem., V2(4):274
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.274]

A lei de Boyle é um caso especial da lei dos gases ideais. Refere-se a um gás contido num sistema fechado e a temperatura constante, para o qual o produto da pressão do gás pelo seu volume apresenta um valor constante. A lei de Boyle pode ser enunciada da seguinte forma:
Para uma dada massa de gás mantida a uma temperatura constante, a pressão e o volume são inversamente proporcionais.
Matematicamente, do enunciado da lei resulta que pV = k  p
p 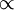 1/V, a temperatura constante (k é uma constante; no caso de se tratar de um gás ideal, k = nRT). Assim, é possível estabelecer uma relação entre os valores da pressão e do volume iniciais e finais (pi e Vi, pf e Vf respectivamente) de um gás que sofre uma expansão ou contracção isotérmica (temperatura constante). Como o produto entre a pressão e o volume é constante, isto é, piVi = k facilmente se depreende que:
1/V, a temperatura constante (k é uma constante; no caso de se tratar de um gás ideal, k = nRT). Assim, é possível estabelecer uma relação entre os valores da pressão e do volume iniciais e finais (pi e Vi, pf e Vf respectivamente) de um gás que sofre uma expansão ou contracção isotérmica (temperatura constante). Como o produto entre a pressão e o volume é constante, isto é, piVi = k facilmente se depreende que:
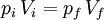
A relação entre a pressão e o volume de um gás foi observada pela primeira vez por dois cientistas amadores, de seu nome Robert Towneley e Henry Power[1]. Os contactos e a correspondência entre Towneley e Robert Boyle, um químico e físico nascido na Irlanda no século XVII, fizeram com que este último testasse e verificasse laboratorialmente as observações de Towneley e Power. Os ensaios laboratoriais foram feitos com ar. Em 1662 Boyle publicou o trabalho[2] hoje conhecido como Lei de Boyle, curiosamente designada no trabalho de Boyle como a “hipótese do Sr. Towneley”. Alguns anos mais tarde, Edme Mariotte, um padre e físico francês do século XVII alcançou, de forma independente (aparentemente), os mesmos resultados de Boyle, tendo publicado o seu trabalho em 1676[3]. Por isso, é frequente encontrar as designações lei de Boyle ou lei de Boyle-Mariotte.
Referências
1. R. M. Hawthorne Jr., J. Chem. Educ. 56 (1979) 741-742; (disponível em http://pubs.acs.org/doi/abs/10.1021/ed056p741, consultado em 06/12/2009)
2. http://jap.physiology.org/cgi/content/full/98/1/31, consultado em 06/12/2009
3. http://en.wikipedia.org/wiki/Edme_Mariotte, consultado em 06/12/2009
Criada em 30 de Dezembro de 2009
Revista em 14 de Setembro de 2010
Aceite pelo editor em 14 de Setembro de 2010
